某工厂废液中含有氯化钠.氯化铜和氯化亚铁。某课外小组要从废液中回收铜并得到铁红(主要成分
),要求全过程不引入其他金属元素。设计实验方案如下图所示,
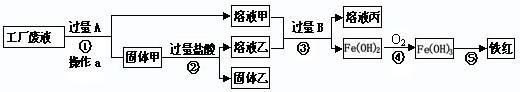 |
回答下列问题。
(1)加入过量
溶解后,再进行操作a时玻璃棒的作用是
(2)工厂废液中加入过量
反应的化学方程式为
(3)溶液甲中的金属离子是
(4)步骤①②③中所发生的化学反应,其中属于置换反应的是
(5)铁红是炼铁的主要原料,写出用
和铁红炼铁的化学方程式
根据下列实验示意图回答问题: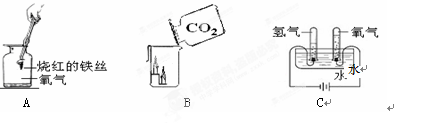
(1)实验A中的实验现象是;写出反应的化学反应方程式;其基本反应类型是。
(2)实验B的结论除说明气体的密度外,还可说明该气体的性质有、。
(3)实验C中氧气与氢气的体积比为,该实验说明水是由组成的。
实验室常用下列装置来制取氧气:
(1)写出图中有标号仪器的名称:a 、b。
(2)用双氧水和二氧化锰来制取氧气时,可选用的发生装置是(填序号),其中二氧化锰起作用。
(3)用高锰酸钾制取氧气时,发生反应的化学反应方程式为。
实验结束,停止加热时要先把导管移出水面,其理由是_;
此时发现水槽中的水变成了浅紫红色,你认为产生该现象的原因可能是;
(4)用E装置收集氧气的依据是,检验氧气是否集满的方法是。
(5)实验室常用氯化铵固体与碱石灰固体共热来制取氨气。常温下NH3是一种无色、有刺激性气味的气体,密度比空气小。NH3极易溶于水。制取并收集NH3,应该从上图中选择的是和(填序号)。
(6)若用分解过氧化氢制取氧气,供选用的装置如下: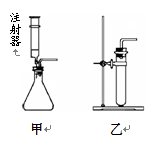
要得到平稳的氧气流,应选用的发生装置是(选填“甲”或“乙”);发生反应的化学方程式为。
在下列微观粒子的示意图中,“ ”和“
”和“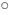 ”分别表示氮原子和氢原子。
”分别表示氮原子和氢原子。
请回答下列问题:
(1)B中的1个分子中含有__________个原子。
(2)C为氨气分子,每个氨气分子是由_______________构成的。
(3)分别由B和D中的粒子构成的物质在一定条件下能反应生成C中粒子构成的物质(氨气),该反应的基本反应类型是_______________,写出该反应的化学方程式:_______________。
(4)以上粒子中,在化学变化中的最小粒子是(填序号)_______________中的粒子,能保持氮气化学性质的最小粒子是(填序号)_______________中的粒子。
已知元素周期表中第三周期各元素原子结构示意图如下,请回答: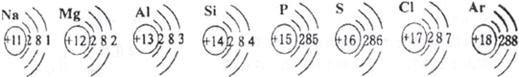
(1)在化学反应中,钠元素的原子容易失去电子变成(填“阴”或“阳”)离子;
(2)元素的化学性质与原子结构中的关系密切;
(3)从原子结构方面看:同一周期的元素具有相同的数;
(4)在此周期中,各元素的原子结构呈现的变化规律是:依次递增。
用化学符号表示:2个氢分子;3个钠离子。
氯化铝;3个硫酸根离子;氩气。