下列表示物质变化的化学用语正确的是
A.碳酸的电离 H2CO3 2H++CO32- 2H++CO32- |
B.氯化铁水解 Fe3++3H2O Fe(OH)3+3H+ Fe(OH)3+3H+ |
C.硫氢化钠的水解 HS-+H2O H3O++S2- H3O++S2- |
D.硫化铝固体在水中不存在 Al2S3+6H2O Al(OH)3+3H2S Al(OH)3+3H2S |
下列化学用语正确的是()
A.含有10个中子的氧原子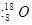 |
B.乙烯的最简式(实验式):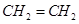 |
C.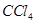 的电子式: 的电子式: |
D.铝离子的结构示意图 |
盛有氯化钡稀溶液的甲、乙两试管分别通入SO2至饱和,若向甲试管中加入足量过氧化钠,乙试管中加入足量氨水,则下列叙述正确的是:
A甲、乙两试管都有白色沉淀生成 B甲、乙两试管都没有白色沉淀生成
C甲试管没有白色沉淀生成而乙试管有 D甲试管有白色沉淀生成而乙试管没有
有关NaHCO3与Na2CO3的说法正确的是
A Na2CO3俗称纯碱,所以Na2CO3属于碱
B 将石灰水加入到NaHCO3溶液中不产生沉淀
C NaHCO3遇到盐酸放出CO2的反应要比Na2CO3剧烈
D 等质量的NaHCO3和Na2CO3与足量的盐酸反应,在相同条件下Na2CO3产生的CO2的体积大
如图所示的实验中,投入铝片后: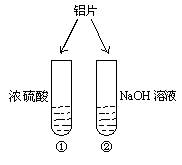
A ①和②中都不产生气泡B ①和②中都产生气泡,且都是H2
C①中产生大量气泡,②中不产生气泡D ①中无明显现象,②中产生大量气泡
下列离子方程式书写正确的是
A二氧化碳通入过量的澄清石灰水中:OH-+CO2=HCO3-
B金属钠投入到水中:2Na+2H2O=2Na++2OH-+H2↑
C次氯酸钙溶液中通入过量的SO2:ClO-+H2O+SO2 = HSO3-+HClO
D向硫酸铜溶液中加入过量氢氧化钡溶液: Ba2++SO42-=BaSO4↓