开链烷烃的分子通式为CnH2n+2(n为正整数),分子中每减少2个碳氢键必然同时增加1个碳碳键,可能形成双键或三键也可能是环状烃,但都称之为增加一个不饱和度。例如:CH3C≡CCH2CH=CH2其不饱和度为3。如图4-2篮烷的结构,其分子式为,不饱和度为__ ____,其一氯取代物有种。
键线式是有机物结构的又一表示方法,如图I所表示物质的键线式可表示为图II所示形式。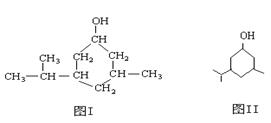
(1)写出图Ⅱ的分子式为_________________ _。
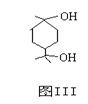
(2)图Ⅲ所表示物质的分子式为___________________。
(3)写出戊烷、环已烷的键线式。
(1)有两种芳香烃结构如下:
萘: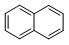 联苯:
联苯: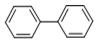
它们的分子式分别为 和。
(2)分子式为C6H12的某烃的所有碳原子都在同一平面上,则该烃的结构简式为____________ ,若分子式为C4H6的某烃中所有的碳原子都在同一条直线上,则该烃的结构简式为______________。
下列各组中的两种有机物,可能是相同的物质、同系物或同分异构体等,请判断它们之间的关系
(1)2-甲基丁烷和丁烷 ________________
(2)正戊烷和2,2-二甲基丙烷___________________
(3)间二甲苯和乙苯_____________________
(4)1-已烯和环已烷____________________________
(1)同系物,(2)同分异构体,(3)同分异构体 (4)同分异构体
28.分子结构中含有两个-CH3、一个-CH2-、一个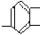 基、一个 -OH,且属于酚类的同分异构体有6种,其结构简式为:__________、_________、_________、_________、_________、__________。
基、一个 -OH,且属于酚类的同分异构体有6种,其结构简式为:__________、_________、_________、_________、_________、__________。