下列说法正确的是( )
| A.复分解反应可能是氧化还原反应 |
B.化合反应 可能是氧化还原反应 可能是氧化还原反应 |
| C.置换反应可能不是氧化还原反应 |
| D.有单质生成的分解反应可能不是氧化还原反应 |
在某2L恒容密闭容器中充入2 mol X(g)和1 mol Y(g)发生反应:2X(g)+Y(g) 3Z(g)△H,反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是
3Z(g)△H,反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是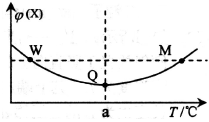
| A.M点时,Y的转化率最大 |
| B.升高温度,平衡常数减小 |
| C.平衡后充入Z达到新平衡时Z的体积分数增大 |
| D.W,M两点Y的正反应速率相等 |
下列有机物同分异构体数目判断错误的是
化学与生活息息相关。下列说法不正确是
| A.用饱和氯化铵溶液可以清洗金属表面的锈 |
| B.NOx、 Cl2、 PM2.5颗粒都会导致酸雨 |
| C.在食品袋中放入盛有硅胶的透气小袋,可防止食物受潮 |
| D.人体摄入大量铝盐易患“老年性痴呆”,明矾不宜大量作净水剂 |
位于不同短周期的两种主族元素X、Y,已知Y的原子序数为X的2倍,下列说法正确的是
| A.X元素原子的半径一定小于Y元素原子的半径 |
| B.Y元素的氧化物不可能与X元素的气态氢化物反应 |
| C.X元素与氢元素形成的化合物中一定不含非极性键 |
| D.Y元素与X元素原子的最外层电子数一定不相等 |
铝是一种高能量载体,是开发电池的理想电极材料。如图所示的室温铝二次电池,采用有机阳离子(EMIm)和AlCl4-组成的离子液体为电解液,有关反应为Al+Mn2O4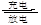 AlMn2O4下列说法正确的是
AlMn2O4下列说法正确的是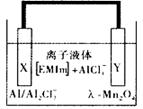
| A.电池放电时,AlCl4-向Y极扩散 |
| B.电池放电时,X是正极 |
| C.电池充电时X极的反应为:4Al2Cl7-+3e-=Al+7AlCl4- |
| D.铝作为负极材料的比能量高于锂 |