已知柠檬醛的结构简式为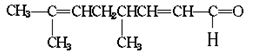
根据已有知识判定下列说法不正确的是
| A.它可使酸性高猛酸钾溶液褪色 | B.它可跟银氨溶液反应生成银镜 |
| C.它可使溴水褪色 | D.它被催化加氢的最后产物的分子式是C10H20O |
(CH3CH2)2CHCH3的正确命名是
| A.3-甲基戊烷 | B.2-甲基戊烷 |
| C.2-乙基丁烷 | D.3-乙基丁烷 |
在C2H2.C6H6.C2H4O组成的混合物中,已知氧元素的质量分数为8%,则混合物中碳元素的质量分数是
| A.92.3% | B.87.6% | C.75% | D.84% |
下列过程没有发生化学反应的是
| A.用活性炭去除冰箱中的异味 |
| B.用热碱水清除炊具上残留的油渍 |
| C.用浸泡过高锰酸钾溶液的砖头储存水果 |
| D.用含硅胶.铁粉的透气小袋与食品一起密封包装 |
废电池的污染引起人们的广泛重视,废电池中对环境形成污染的主要物质是
| A.锌 | B.汞 | C.石墨 | D.二氧化锰 |
未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的是
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能
| A.①②③④ | B.⑤⑥⑦⑧ | C.③⑤⑥⑦⑧ | D.③④⑤⑥⑦⑧ |