居民所用石油液化气的主要成分是丁烷,在使用过程中,常有一些杂质以液态沉积于钢瓶中,这些杂质可能是( )
| A.甲烷和丙烷 | B.乙烷和甲醛 | C.乙烷和丁烷 | D.戊烷和己烷 |
已知0.1 mol·L-1的二元酸H2A溶液的pH=4.0,则下列说法中正确的是()
A.在Na2A、NaHA两溶液中,离子种类肯定不相同
B.在溶质物质的量相等的Na2A、NaHA两溶液中,它们的阴离子总数相等
C.在NaHA溶液中一定有:c(Na+)+c(H+)====c(HA-)+c(OH-)+2c(A2-)
D.在Na2A溶液中一定有:c(Na+)>c(A2-)>c(H+)>c(OH-))
已知X、Y、Z、a四种物质有如右图关系且X+Y Z,则Z不可能为()
Z,则Z不可能为()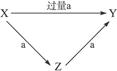
| A.AgOH | B.S | C.Al(OH)3 | D.CaCO3 |
对于相同体积的K2CO3溶液(浓度为c1)和(NH4)2CO3溶液(浓度为c2),若其中 的物质的量浓度相同,则c1和c2的关系是()
的物质的量浓度相同,则c1和c2的关系是()
| A.c1=2c2 | B.c1>c2 | C.c1=c2 | D.c1<c2 |
25 ℃,在某物质的溶液中,水电离出的H+浓度为1×10-a mol·L-1。下列说法中:①a<7时,水的电离受到促进;②a=7时,该溶液呈中性;③a=9时,溶液的pH=9。其中肯定正确的是()
| A.①② | B.②③ | C.①③ | D.①②③ |
有一未知浓度的盐酸25 mL,在加入5 mol·L-1 AgNO3溶液25 mL后,改加NaOH溶液,结果用去1.0 mol·L-1 NaOH溶液25 mL,恰好完全中和,则盐酸的物质的量浓度为()
| A.0.5 mol·L-1 | B.1.0 mol·L-1 | C.1.5 mol·L-1 | D.2.0 mol·L-1 |