下列实验装置正确且能达到相应的实验目的的是 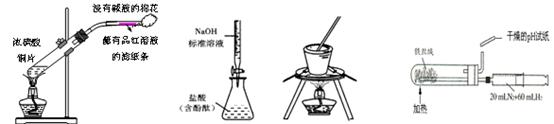
| A.制取SO2并检验SO2的漂白性 | B.测定盐酸浓度检验 |
| C.从食盐水中提取NaCl | D.合成氨并氨的生成 |
下列酸在与金属发生反应时,其中S或N元素的化合价不会发生变化的是
| A.稀硫酸 | B.稀硝酸 | C.浓硫酸 | D.浓硝酸 |
实验室里坩埚的材质种类很多,可以用于熔融烧碱的坩埚是
| A.普通玻璃坩埚 | B.铁坩埚 | C.石英坩埚 | D.陶瓷坩埚 |
分析下列合成路线: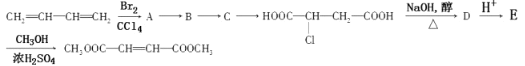
则B物质应为下列哪种物质
A.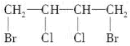 |
B. |
C. |
D.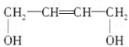 |
已知某有机物X的结构简式如图所示,下列有关叙述不正确的是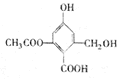
| A.X能使KMnO4溶液褪色 |
| B.X在一定条件下能与FeCl3溶液发生显色反应 |
| C.X在一定条件下能发生消去反应和酯化反应 |
| D.1molX分别与足量的Na、NaOH溶液、NaHCO3溶液反应,消耗这三种物质的物质的量分别为3mol、4mol、1mol |
下列说法不正确的是
A.苯酚与甲醛在酸性条件下生成酚醛树脂的结构简式为 |
| B.(NH4)2SO4和CuSO4溶液都能使蛋白质沉淀析出,但沉淀原理不同 |
| C.醋酸和硬脂酸互为同系物;C6H14和C9H20也一定互为同系物 |
| D.淀粉水解实验:淀粉溶液中加入稀硫酸加热水解得水解液,再加入NaOH溶液得中和液,后加入新制Cu(OH)2悬浊液加热后有红色沉淀。结论:淀粉已水解 |