下列用来表示物质变化时的化学用语中,正确的是
A.氢硫酸溶液显酸性的主要原因:H2S 2H++ S2– 2H++ S2– |
| B.用稀氨水吸收H2S:NH3·H2O + H2S === NH4HS+ H2O |
C.Na2CO3溶液显碱性的主要原因:CO32-+ 2H2O  H2CO3+ 2OH– H2CO3+ 2OH– |
| D.CH3COOH(aq) + NaOH(aq) === CH3COONa (aq) + H2O(l) ΔH=" –57.3kJ/mol" |
相同温度下等物质的量浓度的下列溶液中,pH最小的是( )
| A.NH4Cl | B.NH4HCO3 | C.NH4HSO4 | D.(NH4)2SO4 |
下列说法正确的是( )
| A.可逆反应的特征是正反应速率和逆反应速率相等 |
| B.在其他条件不变时,使用催化剂只能改变反应速率,而不能改变化学平衡状态 |
| C.在其他条件不变时,升高温度可以使平衡向放热反应方向移动 |
| D.在其他条件不变时,增大压强一定会破坏气体反应的平衡状态 |
下列反应属于吸热反应的是()
| A.C6H12O6(葡萄糖aq)+6O2→6CO2+6H2O |
| B.CH3COOH+KOH=CH3COOK+H2O |
| C.反应物的总能量大于生成物的总能量 |
| D.破坏反应物全部化学键所需能量大于破坏生成物全部化学键所需能量 |
在pH=1的无色溶液中,下列离子能大量共存的是()
| A.Fe2+、OH-、SO42-、MnO4- | B.NH4+、Ba2+、NO3-、CO32- |
| C.K+、Mg2+、NO3-、SO42- | D.Na+、Fe3+、Cl-、AlO2- |
下列各组物质:
① O2和O3②12C和14C③乙醇和乙酸
④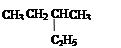 和
和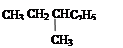
⑤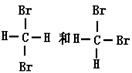
⑥ CH3CH2CH2CH3和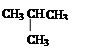
⑦ C2H5OH和C4H9OH
互为同素异形体的是(填序号,下同),互为同位素的是,互为同分异构体的是,是同一物质的是,同系物的是