氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既非氧化剂又非还原剂等。下列反应与Br2+SO2+2H2O=H2SO4+2HBr相比较,水的作用不相同的是:
| A.2Na2O2+2H2O=4NaOH+O2↑ |
| B.4Fe(OH)2+O2+2H2O=4Fe(OH)3 |
C.Cl2+H2O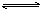 HCl+HClO HCl+HClO |
| D.2Al+2NaOH+2H2O=2NaAlO2+3H2↑ |
下列有关物质检验的操作和实验结论都正确的是
| 选项 |
实 验 操 作 及 现 象 |
实 验 结 论 |
| A |
向某溶液中先加入氯化钡溶液,有白色沉淀生成,再加盐酸酸化,沉淀不溶解 |
该溶液中一定含有SO42- |
| B |
向某溶液中加入2滴KSCN溶液,溶液不显红色。再向溶液中加入几滴新制的氯水,溶液变为红色 |
该溶液中一定含有Fe2+ |
| C |
将某气体通入品红溶液中,品红溶液褪色 |
该气体一定是SO2 |
| D |
向某溶液加入NaOH并微热,产生的无色气体能够使湿润的红色石蕊试纸变蓝。 |
该溶液中一定含有NH4+ |
下列反应的离子方程式正确的是
| A.AgCl不溶于稀硝酸,但可溶于氨水中: AgCl +2 NH3·H2O = [Ag(NH3)2]++ Cl-+2H2O |
| B.双氧水中滴加酸性高锰酸钾,溶液紫红色褪去: 6H++ 2MnO4- + H2O2= 2Mn2+ + 3O2 ↑+ 4H2O |
| C.在硫酸亚铁溶液中通入氧气: 4Fe2++O2+2H2O= 4Fe3++4 OH- |
| D.乙炔气体中混有的硫化氢,可通过盛有CuSO4溶液的洗气瓶: |
Cu2+ + S2- = CuS↓
一些烷烃的燃烧热如下表:
| 化合物 |
燃烧热/kJ·mol-1 |
化合物 |
燃烧热/kJ·mol-1 |
| 甲烷 |
891.0 |
正丁烷 |
2878.0 |
| 乙烷 |
1560.8 |
异丁烷 |
2869.6 |
| 丙烷 |
2221.5 |
异戊烷 |
3531.3 |
下列表达正确的是
| A.正戊烷的燃烧热大于3531.3kJ·mol-1 |
| B.稳定性:正丁烷>异丁烷 |
| C.乙烷燃烧的热化学方程式为: 2C2H6(g)+7O2(g)=4CO2(g)+6H2O(g) ;△H= -1560.8 kJ·mol-1 |
| D.相同物质的量的烷烃CnH2n+2,n越大,燃烧放出的热量越多 |
将0.1mol Cu与40ml 10mol/LHNO3充分反应,测得反应后的溶液里含有a molH+
由此可知
| A.生成的气体一定是NO2,在标准状况下的体积4.48 L |
| B.生成的气体一定是NO,在标准状况下的体积约1.49L |
| C.被还原的硝酸的物质的量为(0.2-a)mol |
| D.反应后的溶液里含有0.2mol NO3- |
下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是 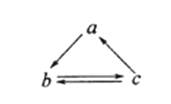
| 物质 选 项 |
a |
b |
c |
| A |
NO |
NO2 |
HNO3 |
| B |
Na2SiO3 |
Si |
SiO2 |
| C |
HCl |
HClO |
Cl2 |
| D |
S |
SO2 |
SO3 |