(1)①液态HCl②BaSO4③氯水④无水乙酸⑤SO2⑥熔融的KCl⑦Cu⑧酒精溶液上述物质属于电解质的是 能导电的是
属于强电解质的是 属于非电解质的是
(2)在标准状况下a. 6.72L CH4气体 b.3.01×10 23个HCl气体分子 c.13.6g H2S气体 d.0.2molNH3,下列对这四种气体的关系从大到小的排列是(用上述序号表示)
23个HCl气体分子 c.13.6g H2S气体 d.0.2molNH3,下列对这四种气体的关系从大到小的排列是(用上述序号表示)
①四种气体的物质的量 ,
②标准状况下四种气体的体积 ,
③四种气体的质量 。
(3)化合物A是一种不稳定的物质,它的分子组成可用 表示。10mLA气体能分解生成15mL
表示。10mLA气体能分解生成15mL 和10mL
和10mL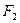 (同温、同压)。
(同温、同压)。
A的化学式是___________。推断理由是___________。
(1)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9kJ·mol-1,H-H键的键能是436.0 kJ·mol-1;由N2和H2合成1molNH3时可放出46.2kJ的热量。
根据上述数据可计算:N-H键的键能是。
(2)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.8 kJ·mol-1
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g)△H=-47.2 kJ·mol-1
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g)△H=+640.5 kJ·mol-1
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式:
_________________。
化学能和电能的相互转化,是能量转化的重要方式之一,如图两个实验装置是实现化学能和电能相互转化的装置。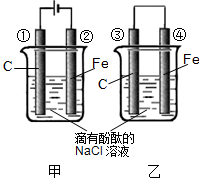
(1)把化学能转化为电能的装置是(填“甲”或“乙”);
(2)④电极上的电极反应式为
(3)①电极上的电极反应式为,
检验该电极反应产物的方法是
(4)写出装置甲的反应总化学方程式。
1.28 g 的铜与足量的浓硝酸充分反应后,可收集到气体mL(标况下)被还原的硝酸的物质的量是。
A、B、C、D四种短周期元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,B与C的单质在加热条件下反应,生成一种淡黄色的固体E;D的L层电子数等于K、M两个电子层上的电子数之和
(1)写元素符号:A为 ,C为 ,D的最高价氧化物的水化物化学式是。
(2)写出A、B形成的化合物与E反应的化学方程式:
(3)E属于(“离子”或“共价”)化合物。
(4)C与D两元素可形成化合物。
下表是周期表中的一部分,根据a—n在周期表中的位置,按要求回答问题:
| ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
|
| 1 |
a |
|||||||
| 2 |
b |
c |
d |
e |
||||
| 3 |
f |
g |
h |
i |
j |
k |
m |
n |
(1)表中元素,只有负价而无正价的元素是,氧化性最强的单质是。(本小题均填物质的名称)
(2)最高价氧化物的水化物中碱性最强的是,呈两性的是,写出它与氢氧化钠反应的离子方程式 。(本小题均用化学式表示)
(3)在b、c、d、f、g、h中,原子半径从大到小的顺序为的是。(用元素符号表示)。
(4) 比较k、m的气态氢化物的稳定性。(用化学式表示)