 、
、 、
、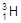 、H+、H2可以表示 ( )
、H+、H2可以表示 ( )
| A.氢的五种同位素 | B.五种氢元素 |
| C.化学性质不同的氢原子 | D.氢元素的五种不同微粒 |
对某弱酸溶液加热时,下列叙述错误的是( )
| A.弱酸的电离程度增大 |
| B.弱酸分子的浓度减小 |
| C.溶液的OH-浓度增大 |
| D.溶液的导电性增强 |
下列物质中,导电性由大到小排列正确的是( )
①500 mL 0.1 mol·L-1的氢氧化钠溶液②100 mL 0.1 mol·L-1的硫酸溶液③500 mL 0.1 mol·L-1的醋酸溶液④1 L 0.1 mol·L-1的酒精溶液
| A.①②③④ | B.④①③② | C.②①③④ | D.①③②④ |
下列各组物质反应中,溶液的导电性比反应前明显增强的是( )
| A.向亚硫酸钠溶液中加液溴 |
| B.向硝酸银溶液中通入少量氯化氢 |
| C.向氢氧化钠溶液中通入少量氯气 |
| D.向硫化氢饱和溶液中通入少量氯气 |
下列有关叙述正确的是( )
| A.强电解质的饱和溶液一定是浓溶液 |
| B.凡是能导电的物质都是电解质 |
| C.氯气不是电解质,所以氯水不导电 |
| D.硫酸是强电解质 |
0.1 mol·L-1HCl溶液和0.1 mol·L-1CH3COOH相比较,下列说法正确的是()
| A.含H+物质的量,盐酸大于醋酸 | B.分别与锌粉反应,产生H2物质的量相等 |
| C.分别与锌粉反应,反应速率盐酸大于醋酸 | D.含H+物质的量浓度,盐酸大于醋酸 |