设NA代表阿伏加德罗常数的值,下列说法正确的是
| A.0℃、1.01×105 Pa时,11.2 L氧气中所含的原子数为NA |
| B.0.1 mol H2O和D2O组成的混合物中含有的中子数是NA |
| C.1 mol CH3+(碳正离子)中含有电子数为10NA |
| D.0.1 L 2 mol·L-1的(NH4)2S溶液中含有的S2-数目为0.2NA |
下列反应中不属于氧化还原反应的是
A.2H2O2 2H2O+O2 2H2O+O2 ↑ ↑ |
B.2Na+2H2O=2NaOH+H2↑ |
C.CaO+SiO2 CaSiO3 CaSiO3 |
D.2KI+Cl2=2KCl+I2 |
铝有较强的抗腐蚀性能,主要是因为
| A.与氧气在常温下不反应 | B.铝性质不活泼 |
| C.铝表面形成了一层致密的氧化膜 | D.铝耐酸耐碱 |
下列物质中,既有离子键,又有 共价键的是
共价键的是
| A.KCl | B.NH4Cl | C.H2O | D.CH4 |
我国稀土资源丰富。下列有关稀土元素14462Sm与15062Sm的说法正确的是
| A.14462Sm与15062Sm互为同位素 |
| B.14462Sm与15062Sm的质量数相同 |
| C.14462Sm与15062Sm是同一种核素 |
| D.14462Sm与15062Sm的核外电子数和中子数均为62 |
下列化学用语书写正确的是
| A.乙醇的结构简式:C2H5OH | B.氯化钠的电子式: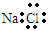 |
C.S2-离子的结构示意图: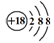 |
D.有8个质子、10个中子的核素:168O |