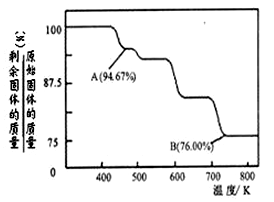
工业碳酸钠(纯度约为98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO42-等杂质,提纯工艺线路如下: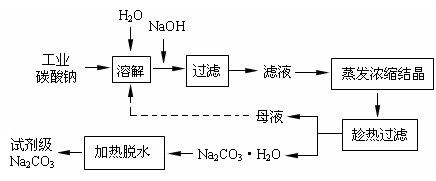
Ⅰ、碳酸钠的饱和溶液在不同温度下析出的溶质如下图所示:
Ⅱ、25℃时有关物质的溶度积如下:
| 物质 |
CaCO3 |
MgCO3 |
Ca(OH)2 |
Mg(OH)2 |
Fe (OH)3 |
| Ksp |
4.96×10—9 |
6.82×10—6 |
4.68×10—6 |
5.61×10—12 |
2.64×10—39 |
回答下列问题: (1)加入NaOH溶液时发生的离子方程式为:_______________________________________;
(1)加入NaOH溶液时发生的离子方程式为:_______________________________________;
25℃时,向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8 时,c(M g2+):c(Fe3+)=__________________________。
g2+):c(Fe3+)=__________________________。
(2)“趁热过滤”时的温度应控制在_____________。
(3)有人从“绿色化学”角度设想将“母液”沿流程中虚线所示进行很多次循环使用。请你分析实际工业生产中是否可行_____________,并说明理由:______________________________________________________________________________。
(4)已知:Na2CO3·10 H2O(s)=Na2CO3(s)+10 H2O(g) △H=+ 532.36kJ·mol—1
Na2CO3·10 H2O(s)=Na2CO3·H2O(s)+9 H2O(g) △H=+ 473.63kJ·mol—1
写出Na2CO3·H2O脱水反应的热化学方程式_______________________________________。
姜黄素(分子式为C21H20O6)具有搞突变和预防肿瘤的作用,其合成路线如下: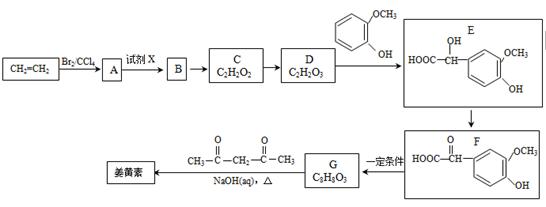
已知
①
②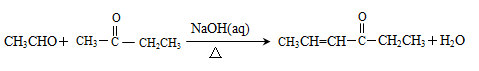
请回答下列问题:
(1)D中含有的官能团名称。
(2)试剂X为。
(3)姜黄素的结构为。
(4)反应D—E的化学方程式为,其反应类型是。
(5)下列有关G(C8H8O3)的叙述不正确的是(填正确答案编号)。
a.能与NaHCO3溶液反应
b.能与浓溴水反应
c.能与FeCl3溶液发生显色反应
d.1molG最多能与3molH2发生加成反应
(6)G(C8H8O3)的同分异构体中,符合下列条件的共有种。
①苯环上的一取代物只有2种;
②1mol该物质与烧碱溶液反应,最多消耗3molNaOH.
其中核磁共振氢谱中有4组吸收峰的同分异构体的结构简式为。
已知X,Y,Z,Q为短周期非金属元素,R是长周期元素,X原子的电子占据2个电子层且原子中成对电子数是未成对电子数的2倍;Y的基态原子有7种不同运动状态的电子;Z元素在地壳中含量最多;Q是电负性最大的元素;R+离子只有三个电子层且完全充满电子。
回答下列问题:(答题时,X、Y、Z、Q、R用所对应的元素符号表示)
(1)X元素为,X、Y、Z中第一电离能最大的是。
(2)已知Y2Q2分子存在如图所示的两种结构(球棍模型,短线不一定代表单键):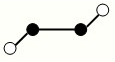
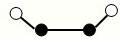
该分子中Y原子的杂化方式是。
(3)X与Y元素可以形成一种超硬新材料,其晶体部分结构如图所示,有关该晶体的说法正确的是(填正确答案编号)。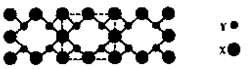
| A.该晶体属于分子晶体 |
| B.此晶体的硬度比金刚石还大 |
| C.晶体的化学式是X3Y4 |
| D.晶体熔化时破坏共价键 |
(4)有一种AB型分子与Y单质分子互为等电子体,它是一种常用的还原剂,其化学式为。
(5)R的基态原子的电子排布式为,R与Z形成的某离子晶体的晶胞结构如图,则该晶体的化学式为,该晶体的密度为a g·cm-3,则晶胞的体积是cm3。
某地有丰富的铝土矿和石灰石资源,拟用铝土矿(主要成分是Al2O3,还有少量的Fe2O3、SiO2)为原料冶炼铝,工艺流程如下图所示: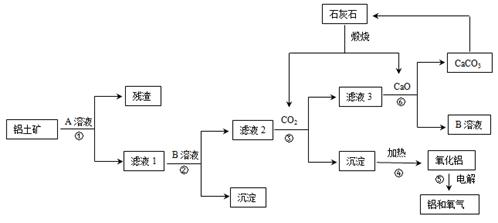
(1)原料A的名称是,可循环使用的物质的化学式式为。
(2)如果省去步骤①,即溶解铝土矿从直接加入B溶液开始,则最终会对氧化铝的生产产生的影响是。
(3)写步骤③的离子方程式。
(4)步骤⑤是在铝电解槽中进行,电解槽的两极材料均用石墨,写出阴极的电极反应方程式。
(5)工业常用阳极氧化法使铝的表面生成致密的氧化膜。如右图是铝阳极氧化实验装置图:a端是电源的极。铝片表面形成氧化铝的原理是(用电极方程式表示),(填“能”或“不能”)用较浓NaCl溶液代替20%H2SO4作电解液进行铝的阳极氧化,若不能,请说明理由。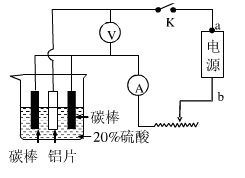
有一种广泛用于汽车、家电产品上的高分子涂料,按下列流程图生产。流程图中M(C3H4O)和A都可以发生银镜反应,N和M的分子中碳原子数相等,A的烃基上一氯取代位置有三种。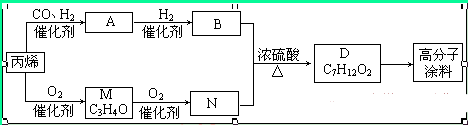
填写下列空白:
⑴物质的结构简式:A_________,高分子涂料___________________。
⑵写出下列转化的反应类型:A→B_____,B→D______。
⑶写出下列反应的化学方程式:
A发生银镜反应:_______________________________________________,
B与N反应生成D:_______________________________________________。
环境污染中除了有害气体产生的空气污染外,重金属离子在溶液中引起的水体污染也相当严重.近年来城市汽车拥有量呈较快增长趋势,汽车尾气的主要有害成分一氧化碳和氮氧化物加重了城市空气污染.研究NO2、SO2、CO等大气污染气体的处理及研究重金属离子水污染的处理具有非常重要的意义.
(1)一定条件下,NO2与SO2反应生成SO3和NO两种气体.将体积比为1∶2的NO2、SO2气体置于密闭容器中发生上述反应,若测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K=.
(2)工业上常用Na2CO3溶液吸收法处理氮的氧化物(以NO和NO2的混合物为例).
已知:NO不能与Na2CO3溶液反应.
NO+NO2+Na2CO3=2NaNO2+CO2;2NO2+Na2CO3=NaNO2+NaNO3+CO2
用足量的Na2CO3溶液完全吸收NO和NO2的混合物,每产生22.4L(标准状况)CO2(全部逸出)时,吸收液质量就增加44g,则混合气体中NO和NO2的体积比为.
(3)如图是MCFC燃料电池,它是以水煤气(CO、H2)为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质.A为电池的极(选填“正”或“负”).写出B极电极反应式.
 (4)含铬化合物有毒,对人畜危害很大.因此含铬废水必须进行处理才能排放.
(4)含铬化合物有毒,对人畜危害很大.因此含铬废水必须进行处理才能排放.
已知:
在含+6价铬的废水中加入一定量的硫酸和硫酸亚铁,使+6价铬还原成+3价铬;再调节溶液pH在6~8之间,使Fe3+和Cr3+转化为Fe(OH)3、Cr(OH)3沉淀而除去.用离子方程式表示溶液pH不能超过10的原因.
(5)铬化学丰富多彩,由于铬光泽度好,常将铬镀在其他金属表面,同铁、镍组成各种性能的不锈钢,CrO3大量地用于电镀工业中.
CrO3具有强氧化性,热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如图所示.则B点时剩余固体的成分是(填化学式).