下列叙述正确的是
| A.Ca(OH)2的饱和溶液的导电能力很弱,所以Ca(OH)2是弱电解质 |
| B.CaCO3在水中溶解度虽然小,但溶解的CaCO3全部电离,所以CaCO3是强电解质 |
C.氨水和氯水的导电性很好 ,所以,一水合氨与氯气均为强电解质 ,所以,一水合氨与氯气均为强电解质 |
| D.SO2的水溶液能够导电,所以SO2属于电解质 |
我国科学家卢嘉锡与法裔加拿大科学家Gignere巧妙地利用尿素(H2NCONH2)和H2O2形成加合物H2NCONH2·H2O2,不但使H2O2稳定下来,而且结构也没有发生改变,得到了可供做衍射实验的单晶体,经测定H2O2结构如图所示,结合以上信息,有关过氧化氢的说法不正确的是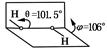
| A.H2NCONH2与H2O2是通过氢键结合的 |
| B.H2O2是极性分子 |
| C.H2O2既有氧化性又有还原性 |
| D.H2NCONH2·H2O2属于离子化合物 |
实验测得 BeCl2为共价化合物,两个Be—Cl键间的夹角为180°则BeCl2属于
| A.由极性键构成的极性分子 | B.由极性键构成的非极性分子 |
| C.由非极性键构成的极性分子 | D.由非极性键构成的非极性分子 |
在硼酸[B(OH)3]分子中,B原子与3个羟基相连,其晶体具有与石墨相似的层状结构。则分子中B原子杂化轨道的类型及同层分子间的主要作用力分别是( )
| A.sp,范德华力 | B.sp2,范德华力 |
| C.sp2,氢键 | D.sp3,氢键 |
最近科学家发现一种由钛原子和碳原子构成的气态团簇分子,如图所示,顶角和面心的原子是钛原子,棱的中心和体心的原子是碳原子,则它的化学式是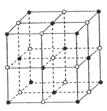
| A.TiC | B.Ti6C7 |
| C.Ti14C13 | D.Ti13C14 |
下列原子或离子原子核外电子排布不属于基态排布的是( )
| A.N: 1s22s22p3 | B.S2-: 1s22s22p63s23p6 |
| C.Na: 1s22s22p53s2 | D.Si: 1s22s22p63s23p2 |