下列说法正确的是
A.MnO2+4HCl MnCl2 +Cl2 + 2H2O中,氧化剂和还原剂物质的量之比为1:4 MnCl2 +Cl2 + 2H2O中,氧化剂和还原剂物质的量之比为1:4 |
| B.2H2S+ SO2 =3S+2H2O中,氧化产物和还原产物物质的量之比为1:1 |
C.3S+ 6KOH =2K2S+ K2SO3+3H2O中,被氧化和被还原的硫元素物质的量之比为2:1 |
| D.5NH4NO3=4N2+2HNO3+9H2O中,反应中发生氧化反应和发生还原反应的氮元素物质的量之比为5:3 |
某分子式为C10H20O2的酯,在一定条件下可发生如下图的转化过程: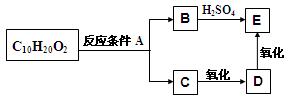
则符合上述条件的酯的结构可有
| A.2种 | B.4种 | C.6种 | D.8种 |
下列离子方程式正确的是
A.乙酸与碳酸钠溶液反应:2H++CO == CO2↑+H2O == CO2↑+H2O |
| B.醋酸溶液与新制氢氧化铜反应:2H++Cu(OH)2—→Cu2++2H2O |
| C.苯酚钠溶液中通入少量二氧化碳: 2C6H5O-+CO2+H2O  2C6H5O 2C6H5O H+CO H+CO |
| D.甲醛溶液与足量的银氨溶液共热 |
HCHO+4[Ag(NH3)2]++4OH- CO
CO +2NH
+2NH +4Ag↓+6NH3+2H2O
+4Ag↓+6NH3+2H2O
黄曲霉素的结构如图,1 mol该化合物分别与H2、NaOH溶液反应,最多消耗H2和 NaOH分别为
| A.6 mol 2 mol | B.7 mol 2 mol |
| C.6 mol 1 mol | D.7 mol 1 mol |
可以将六种无色液体:C2H5OH、AgNO3溶液,C2H5Br、KI溶液,C6H5OH溶液,C6H6一一区分开的试剂是
| A.HCl溶液 | B.溴水 | C.酸性KMnO4溶液 | D.NaOH溶液 |
下列叙述正确的是
| A.淀粉、纤维素、油脂都属于高分子化合物 |
| B.能发生酯化反应的酸一定都是羧酸 |
| C.淀粉与纤维素互为同分异构体 |
| D.油脂水解得到的醇是丙三醇 |