有两只串联的电解池(Pt为电极),甲池盛有足量的CuSO4溶液,乙池盛有足量的某硝酸盐的稀溶液。电解时当甲池电极析出6.4gCu时,乙池电极析出21.6g 金属,则乙池的溶质可能是( )
金属,则乙池的溶质可能是( )
| A.NaNO3 | B.Cu(NO3)2 | C.Al(NO3)3 | D.AgNO3 |
下列各项实验操作不能达到目的的是
| A.在蔗糖溶液中加入几滴稀硫酸,水浴加热5 min,加入NaOH溶液至碱性, 再加入银氨溶液并水浴加热检验葡萄糖的生成 |
| B.苯中混有苯酚可与足量氢氧化钠溶液反应后分液除去 |
| C.使C2H5Br和NaOH溶液混合后水解,取上层清液,滴加AgNO3溶液检验溴元素 |
| D.只用溴水一种试剂即可鉴别甲苯、己烯、乙醇、四氯化碳四种液体 |
下列对有机物结构或性质的描述,错误的是
| A.不同条件下,Cl2可在甲苯的苯环或侧链上发生取代反应 |
| B.苯酚钠溶液中通入CO2生成苯酚和Na2CO3 |
C.乙基对羟基的影响,使羟基的活性变弱,所以乙醇电离出H 的能力不如H2O 的能力不如H2O |
| D.光照下2,2—二甲基丙烷与Br2反应其一溴取代物只有一种 |
下列各物质中,一定互为同系物的是
| A.甲醛和C4H8O | B.醋酸和硬脂酸 |
| C.乙二醇和甘油 | D. 和 和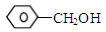 |
下列物质所属的类别及其所含官能团的对应关系可能有错误的是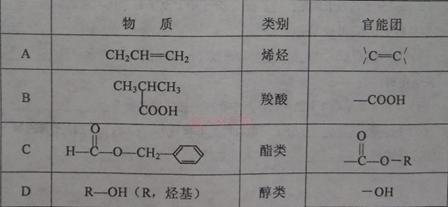
下列反应的离子方程式书写正确的是()
| A.向银氨溶液中加入盐酸:[Ag(NH3)2]++OH—+3H+=Ag++2NH4++H2O |
| B.NaHCO3溶液和少量Ba(OH)2溶液混合:HCO3— +OH—+Ba2+=H2O+BaCO3↓ |
C.硫酸铝溶液显酸性:Al3++3H2O Al(OH) 3↓+3H+ Al(OH) 3↓+3H+ |
| D.在少量Mg(OH)2悬浊液中滴加氯化铵浓溶液:Mg(OH)2+2NH4+=2NH3·H2O+Mg2+ |