实验室配制1mol·L-1盐酸250mL,下列不需用的仪器 是( )
是( )
① 250mL容量瓶 ②托盘天平 ③胶头滴管 ④烧杯
⑤玻璃棒 ⑥药匙 ⑦量筒 ⑧漏斗
| A.②③⑦ | B.②⑤⑥ | C.⑥⑦⑧ | D.②⑥⑧ |
一定条件下,CH3COONa溶液存在水解平衡:CH3COO-+H2O CH3COOH+OH-,下列说法正确的是
CH3COOH+OH-,下列说法正确的是
| A.加入少量NaOH固体,c(CH3COO-)减小 |
| B.加入少量FeCl3固体,c(CH3COO-)减小 |
| C.稀释溶液,溶液的pH增大 |
| D.加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
常温下,已知pH=2的高碘酸溶液与pH=12的NaOH溶液等体积混合,所得溶液显酸性,则下列说法中正确的是
| A.HIO4是一元强酸 |
| B.此混合溶液中c(Na+)=c(IO4-) |
| C.c(H+)·c(OH-)=10-14 mol2·L-2 |
| D.0.1 mol·L-1的HIO4溶液与0.1 mol·L-1的NaOH溶液等体积混合,所得溶液显中性 |
在下列各微粒中,能使水的电离平衡向正方向移动,而且溶液的pH小于7是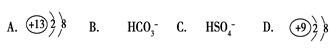
某浓度的氨水中存在下列平衡:NH3·H2O NH4++OH-,如想增大NH4+的浓度,而不增大OH-的浓度,应采取的措施是
NH4++OH-,如想增大NH4+的浓度,而不增大OH-的浓度,应采取的措施是
| A.适当升高温度 | B.加入NH4Cl固体 |
| C.通入NH3 | D.加入少量NaOH |
下列离子反应方程式中,属于水解反应的是
A.CN-+H2O HCN+OH- HCN+OH- |
B.NH3·H2O NH4++OH- NH4++OH- |
C.HCO3-+H2O H3O++CO32- H3O++CO32- |
D.H2CO3 HCO3-+H+ HCO3-+H+ |