(14分). 复印机使用的墨粉主要成分是Fe3O4,下图是氧化沉淀 法生产Fe3O4的工艺:
法生产Fe3O4的工艺: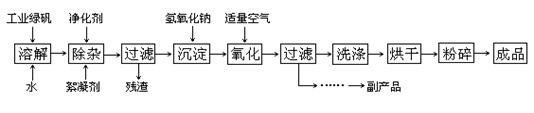
已知:① 工业绿矾中FeSO4的含量为52.5%,其中的杂质不参与反应;
② Fe(OH)2+2Fe(OH)3=Fe3O4·4H2O
③ 12.16﹡1000﹡52.5%=6384,6384/152=42请回答下列问题:
(1)铁的常见氧化物有 ;
(2)Fe3O4与稀硝酸反应的离子方程式是 ,检验反应后的溶液中含Fe3+的方法 ;
(3)在工艺流程中,通入适量空气“氧化”时的化学方程式是: ;
(4)生产中可获得的副产品是 ,提取该副产品的操作顺序是 (填写序号)
a.过滤 b.加热浓缩 c.冷却 d.结晶 e.洗涤
(5)在生产过程中,若工业绿矾的投料速率是12.16 kg/h,为使产品较纯,鼓入空气的速率应为 L/h(假设反应在标准状态下进行,空气中O2占20%)。
某物质的分子式为C4H10O。
(1)它能被催化氧化生成相同碳原子数的醛有_________种,
它们对应的醇分别为(写结构简式)___________,___________。
(2)它能被催化氧化成相同碳原子数的酮有种,写出结构简式并命名_________,___________。
(3)不能被催化氧化的醇的结构简式和名称___________,___________。
(4)能发生消去反应,有机产物只有一种物质的有_________种;两种的有_________种,产物的结构简式为_________和_________。
(探究题)乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物。
完成下列各题:
(1)正四面体烷的分子式为________________,其二氯取代产物有______________种。
(2)关于乙烯基乙炔分子的说法错误的是____。
a.能使酸性KMnO4溶液褪色
b.1 mol乙烯基乙炔能与3 mol Br2发生加成反应
c.乙烯基乙炔分子内含有两种官能团
d.等质量的乙炔与乙烯基乙炔完全燃烧时的耗氧量不相同
(3)写出与环辛四烯互为同分异构体且属于芳香烃的分子的结构简式:__________________。
现有分子式都是C7H8O的芳香族化合物A、B、C三种物质。若各取少许分别滴加FeCl3溶液,只有C呈紫色;若投入金属钠,只有B无明显变化。
(1)写出A、B的结构简式______。
(2)C有多种同分异构体,若其一溴代物最多有两种,C的这种同分异构体的结构简式为________。
有机化合物A是人工合成的香料茉莉酮,其结构简式如图:
(1)该化合物中碳原子数目是_________,分子式是__________。
(2)1 mol该有机物与H2充分反应,消耗_________H2 mol。
(3)该有机物能否发生银镜反应?_____________________________。
实验室做乙醛和银氨溶液发生银镜反应的实验时:
①为产生光亮的银镜,试管用蒸馏水洗涤后再用_________溶液煮沸,倒掉煮沸液后再用清水将试管冲洗干净。
②配制银氨溶液时向盛有________溶液的试管中逐滴滴加_________溶液边滴边振荡直到_________为止。有关反应的化学方程式:____________________、___________________。
③加热时应用_________加热,产生银镜的化学方程式为________________________________。