下列叙述正确的是
| A.1.00mol NaCl中含有6.02×1023个NaCl分子 |
| B.1.00mol NaCl中,所有Na+的最外层电子总数为8×6.02×1023 |
C.欲配置1.00L ,1.00mol.L-1的NaCl溶液, 可将58.5g NaCl溶于1.00L水中 可将58.5g NaCl溶于1.00L水中 |
| D.电解58.5g 熔融的NaCl,能产生22.4L氯气(标准状况)、23.0g金属钠 |
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下: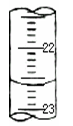
①用0.1000mol/L的标准盐酸润洗酸式滴定管2~3次
②取标准盐酸注入酸式滴定管至“0”刻度以上2~3mL处
③把盛有标准盐酸的酸式滴定管固定好,调节滴定管尖嘴使之充满溶液
④调节液面至“0”或“0”刻度以下,记下读数
⑤取20.00mL待测NaOH溶液注入洁净的锥形瓶中,并加入2~3滴甲基橙试液
⑥把锥形瓶放在滴定管的下面,用标准盐酸滴定至终点,记录滴定管读数
请回答下列问题:
(1)判断到达滴定终点的现象是。
(2)某次滴定时的滴定管中的液面如右图所示,其读数为mL。
(3)根据下列数据:
| 滴定次数 |
待测液体积(mL) |
标准盐酸体积(mL) |
|
| 滴定前读数(mL) |
滴定后读数(mL) |
||
| 第一次 |
20.00 |
0.50 |
25.40 |
| 第二次 |
20.00 |
4.00 |
29.10 |
请计算待测烧碱溶液的浓度为mol/L。
(4)下列实验操作会使实验结果偏高的是。
A、锥形瓶用待测液润洗后再注入待测液
B、酸式滴定管未用标准液润洗,便装入标准液
C、酸式滴定管滴定前俯视读数,滴定后仰视读数
D、酸式滴定管滴定前有气泡,滴定后无气泡
请回答下列问题:
(1)①现有0.1mol/L的纯碱溶液,若用pH试纸测定溶液的pH,其正确的操作是。
②纯碱溶液呈碱性的原因是(用离子方程式表示)。
(2)①已知4.4g丙烷完全燃烧生成二氧化碳气体和液态水,并放出222.0kJ的热量,请写出反应的热化学方程式:。
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890kJ/mol,实验测得甲烷与丙烷的混合气体1mol完全燃烧生成液态水和二氧化碳气体时,放热1776.7kJ,则混合气体中甲烷与丙烷的体积比为。
pH=11的x、y两种碱溶液各5mL,分别稀释至500mL,其pH
与溶液体积(V)的关系如图所示,下列结论正确的是
| A.相同温度下,x的的电离平衡常数小于y |
| B.若x、y是一元碱,等物质的量浓度的盐酸盐溶液,y的pH大 |
| C.若x、y都是弱碱,则a的值一定大于9 |
| D.完全中和x,y两溶液时,消耗同浓度稀硫酸的体积V(x)>V(y) |
高温下,某反应达到平衡,平衡常数K=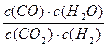 。恒容时,温度升高,H2浓度减小。下列说法正确的是
。恒容时,温度升高,H2浓度减小。下列说法正确的是
| A.该反应是焓变为正值 | B.恒温恒容下,增大压强,H2浓度一定减小 |
| C.升高温度,逆反应速率减小 | D.该反应化学方程式为CO+H2O CO2+H2 CO2+H2 |
在一定温度下,向容积固定不变的密闭容器中充入a mol PCl5,发生如下反应:
PCl5(g)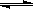 PCl3(g)+Cl2(g);达平衡后再向容器中充入amol PCl5,再次达到平衡后,与原平衡比较,下列叙述不正确的是
PCl3(g)+Cl2(g);达平衡后再向容器中充入amol PCl5,再次达到平衡后,与原平衡比较,下列叙述不正确的是
| A.混合气体的密度增大 | B.相对平均分子质量增大 |
| C.PCl5的转化率提高 | D.PCl5的质量分数增大 |