运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应N2(g)+3H2(g) 2NH3(g),在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”、“向右”或“不”);使用催化剂使反应的△H (填“增大”、“减小”或“不改变”)。
2NH3(g),在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”、“向右”或“不”);使用催化剂使反应的△H (填“增大”、“减小”或“不改变”)。
(2)在25℃下,向浓度均 为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,沉淀会分步析出。
为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,沉淀会分步析出。
首先生成沉淀的离子方程式为 __________________
氨水过量后,生成的沉淀会部分溶解,写出溶解沉淀的离子方程式__________________________.
( 已知25℃时Ksp[Mg(OH)2]=1.8×10-11, KsP[Cu(OH)2]=2.2×10- 20 )
20 )
(3)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应后溶液中
c(NH4+) = c(Cl-)。则溶液显 _____ 性(填“酸”、“碱”或“中”),请用含a的代数式表示NH3·H2O的电离常数Kb= 。
(4) 在一个固定容积为5L的密闭容器中充入0.20 mol SO2和0.10molO2,半分钟后达到平衡,测得容器中含SO3 0.18mol,则v(o2)= mol.L-1.min-1:若继续通入0.20mol SO2和0.10mol O2,再次达到平衡后, n(SO3)的取值范围为________________。
下列四组物质中,前者属纯净物,后者属于混合物的一组是
| A.天然气、空气 | B.氯化钠、食醋 |
| C.矿泉水、白酒 | D.自来水、大理石 |
如图所示: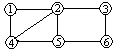 ,每个编号代表下列物质中的一种物质,凡是用直线相连的两种物质均能发生化学反应。供填写的物质有:a.Na2CO3溶液;b.MgSO4溶液;c.BaCl2溶液;d.稀H2SO4;e.Fe;f.Cu(NO3)2溶液。图中编号④代表的物质是
,每个编号代表下列物质中的一种物质,凡是用直线相连的两种物质均能发生化学反应。供填写的物质有:a.Na2CO3溶液;b.MgSO4溶液;c.BaCl2溶液;d.稀H2SO4;e.Fe;f.Cu(NO3)2溶液。图中编号④代表的物质是
| A.e | B.d | C.a | D.c |
将一定质量的金属钠放入100ml浓度为0.5 mol/L的氯化铝溶液中,反应后得到无色澄清溶液,其中除水外只含NaCl和NaAlO2,则加入的金属钠的质
| A.4.6克 | B.3.45 克 | C.1.15 克 | D.7.9克 |
下列物质中的杂质(括号内为杂质)的检验、除杂的试剂或方法正确的是
| 物质及其杂质 |
检验 |
除杂 |
||||
|
观察颜色或湿润的淀粉KI试纸 |
水 |
某透明的溶液中,下列各组离子能大量共存的是
| A.CH3COO-、Cl-、Ca2+、NO3- | B.Mg2+、I-、K+、SO42- |
| C.H+、NH4+、F-、Na+ | D.Fe3+、Cl-、SCN-、Na+ |