右下图装置可用于多项定量实验。图中夹持固定装置已略去,甲有刻度,供量气用。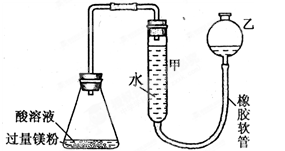
( 1 )装置中有刻度的甲管可以用______________代替 (填仪器名称),按图连接好装置后,检查装置气密性的方法是______________________________
( 2 )某实验小组用镁粉、盐酸、醋酸设计实验来证明:在同温同压下,当上述两种酸的物质的量相同时,与镁粉反应生成氢气的体积相同而反应速率不同。装置如右图所示,
有关实验数据记录于下表:
| 酸溶液 |
酸溶液 |
气体体积/mL |
反应时间 |
|
| (实验A) |
(实验B) |
(25℃、101 kPa) |
实验A |
实验B |
| CH3COOH 0.1 mol/L 40.00mL |
HCl溶液 0.1 mol/L 40.00mL |
5 |
t(a1)="155" s |
t(b1)="7" s |
| 10 |
t(a2)="310" s |
t(b2)="16" s |
||
| 15 |
t(a3)="465"  s s |
t(b3)="30" s |
||
| 20 |
t(a4)="665" s |
t(b4)="54" s |
||
| …… |
…… |
…… |
请回答下列问题:
①每次实验至少需要用电子天平(能称准1 mg) 称取镁粉___________________g;
②冷却到25℃后,在读取气体体积时,首先应如何操作:__________________________;
③分析实验数据,t(a1)远远大于t(b1)的原因是__________________ ________。
________。
(3)用图示装置,某同学设计了测定镀锌铁皮镀层厚度的实验方案,将单侧面积为S cm2、质量为mg的镀锌铁皮与6mol·L—1 NaOH溶液反应。回答下列问题:(已知锌的密度为ρ g/cm3)
① 写出Zn镀层与NaOH溶液反应的离子方程式________________________________________
②为提高测定的准确性,需将锥形瓶上的单孔橡胶塞换为双孔橡胶塞,另一孔插入______(填仪器名称)
实验时先向锥形瓶中加入镀锌铁皮样品,塞上双孔塞,再加入NaOH溶液;
③ 已知实验前后甲管中液面读数差为V mL(实验条件的气体摩尔体积为Vm mol·L—1)。则镀锌铁皮的锌镀层厚度为_________________________cm。(写出数学表达式)
下列离子组一定能大量共存的是
| A.甲基橙呈黄色的溶液中:I-、Cl-、NO3-、Na+ | B.石蕊呈蓝色的溶液中:Na+、AlO2-、NO3-、HCO3- |
| C.含大量Al3+的溶液中:K+、Na+、NO3-、ClO- | D.含大量OH一的溶液中:CO32-、Cl-、F-、K+ |
下列说法正确的是
| A.常温下,某溶液中由水电离的C(OH-)=10-3 mol/L,则该溶液可能为NH4Cl或NaOH溶液 |
| B.常温时浓度均为1 mol/L的KHCO3和K2CO3溶液中,由水电离的C(OH-)前者大于后者 |
| C.1 mL PH=1的H2SO4与100 mLNaOH溶液混合后PH=7,则原NaOH溶液PH=11 |
| D.25℃时PH=5的CH3COOH溶液和100℃时PH=5的AlCl3溶液C(H+)相等 |
根据下图,下列判断中正确的是
| A.烧杯a中的溶液pH升高 |
| B.烧杯b中发生还原反应 |
C.烧杯a中发生的反应为2H++2e -=H2 -=H2 |
| D.烧杯b中发生的反应为2Cl--2e-=Cl2 |
能在水溶液中大量共存的一组离子是
| A.H+、I―、NO3―、SiO32- | B.Ag+、Fe3+、Cl―、SO42― |
| C.K+、SO42-、Cu2+、NO3― | D.NH4+、OH-、Cl-、HCO3- |
用 0.1 mol·L NaOH溶液滴定0.1 mol·L
NaOH溶液滴定0.1 mol·L 盐酸,如果达到滴定终点时不慎堕加了1滴NaOH溶液(1滴溶液约为0.05 mL),继续加水至50 mL,所得溶液的PH是
盐酸,如果达到滴定终点时不慎堕加了1滴NaOH溶液(1滴溶液约为0.05 mL),继续加水至50 mL,所得溶液的PH是
| A.4 | B.7.2 | C.10 | D.11.3 |