某结晶水合物含有两种阳离子和一种阴离子。称取两份质量均为 45.3g 的该结晶水合物,分别制成溶液。向其中一份逐滴加人 NaOH 溶液,开始发现溶液中出现白色沉淀并逐渐增多;一段时间后有气体逸出,该气体有刺激性气味,能使湿润的红色石蕊试纸变蓝,加热后共计可收集到 2 .24L 该气体(标准状况);最后白色沉淀逐渐减少并最终消失。另一份逐滴加人 Ba (OH)2溶液,开始现象类似,但最终仍有白色沉淀;过滤,用稀硝酸处理沉淀物,经洗涤和干燥,得到白色固体 46.6g 。
请回答以下问题:
(1)试通过计算确定该结晶水合物的化学式(要求写出计算过程)。
(2)假设过程中向该溶液中加人的 NaOH 溶液的物质的量浓度为5mol·L一1, 请在右图中画出生成沉淀的物质的量与加入 NaOH 溶液体积的关系示意图。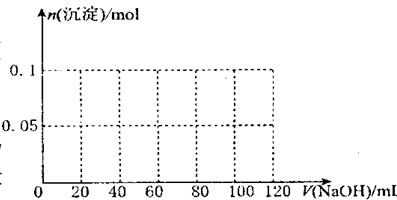
在化学反应中不可能实现的是()
| A.一种原子变成另一种原子 |
| B.一种分子变成另一种分子 |
| C.一种离子变成另一种离子 |
| D.一种单质变成另一种化合物 |
不直接构成物质的是()
| A.原子 | B.离子 | C.分子 | D.电子 |
就原子结构模型的演变历史给我们的启迪的一些说法,错误的是()
| A.继承、积累、突破和革命是化学认识发展的形式 |
| B.道尔顿的原子学说存在缺陷和错误,因而意义不大 |
| C.实验手段的不断进步是化学发展的一个关键,没有科学实验,就没有科学发现 |
| D.科学研究、科学发现是无止境的 |
提出近代原子学说的科学家是有“近代化学之父”美称的()
| A.道尔顿 | B.拉瓦锡 | C.汤姆生 | D.卢瑟福 |
许多地区的自来水是利用氯气消毒的,为了检验Cl-的存在,最好选用下列物质中的( )
| A.紫色石蕊试液 | B.四氯化碳溶液 |
| C.氢氧化钠溶液 | D.硝酸银溶液 |