对于处于平衡状态的可逆反应:A(g)+2B(g) 2C(g)(正向放热)下列叙述正确的是( )
2C(g)(正向放热)下列叙述正确的是( )
A.增大压强,正反应速率增大,逆反应速度减小,平衡正向移动
B.升高温度,逆反应速率增大,正反应速度减小,平衡逆向移动
C.使用催化剂,平衡不移动,但可缩短达到平衡所需时间
D.扩大容器的容积,平衡逆向移动,A、B的浓度增大
主族元素R的最高正化合价为+2,R元素位于周期表的
| A.ⅠA族 | B.ⅡA族 | C.ⅢA族 | D.ⅤA族 |
下列有关说法正确的是
| A.H2SO4的酸性比HClO的酸性强,所以S的非金属性比Cl强 |
| B.Mg(OH)2是中强碱,Al(OH)3是两性氢氧化物,所以Al比Mg活泼 |
| C.H2S 300℃时开始分解,H2O 1000℃时开始分解,说明O的非金属性比S强 |
| D.Na和Mg与酸都能激烈反应放出氢气,故无法比较它们的金属性强弱 |
下列分子中有三个原子核的是
| A.HF | B.NH3 | C.H2O | D.CH4 |
下列各组中属于同位素关系的是
A. 与 与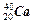 |
B.T2O与H2O | C. 与 与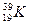 |
D.金刚石与石墨 |
在锌与铜作为电极与稀硫酸组成的原电池中,下列说法正确的是
| A.锌是负极,发生氧化反应 | B.锌是正极,发生氧化反应 |
| C.铜是负极,发生氧化反应 | D.铜是正极,发生氧化反应 |