同温同压下,等体积的两容器内分别充满14N16O和13C16O气体,下列对两容器中气体判断正确的是
| A.中子数相同 | B.分子数不同 | C.质子数相同 | D.气体质量相同 |
与溴水反应不会产生沉淀的是
| A.乙烯 | B.AgNO3溶液 | C.H2S | D.苯酚 |
下列化学用语使用正确是
A.氧原子能量最高的电子的电子云图: |
| B.35Cl与37Cl互为同素异形体 |
C.CH4分子的比例模型: |
D.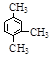 的命名:1,3,4-三甲苯 的命名:1,3,4-三甲苯 |
化学与人类生活密切相关。下列说法正确的是
| A.矿物油和植物油都可以通过石油分馏来获取 |
| B.硫酸亚铁可作补血剂组成成分 |
| C.蛋白质的水解产物都是α-氨基酸 |
| D.造成PM2.5的直接原因是土壤沙漠化 |
下图中甲池是以甲醇为原料,KOH为电解质的高效燃料电池,电化学过程的如图。
下列说法中不正确的是
| A.甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O |
| B.若乙池中为足量AgNO3溶液,则阳极的电极反应为: 4OH--4e- = 2H2O+O2↑ |
| C.若乙池中为一定量CuSO4溶液,通电一段时间后,向所得的溶液中加入0.1mol Cu(OH)2后恰好恢复到电解前的浓度和pH,则电解过程中转移的电子数为0.2NA |
| D.常温常压下,1 g CH3OH燃料生成CO2和液态H2O时放热22.68 kJ,表示该反应的热化学方程式为:CH3OH(l)+1.5O2(g)==CO2(g)+2H2O(l) ΔH=" -725.76" kJ·mol-1 |
分了式为C6H12O2并能与NaHCO3发生反应生成气体的有机物有x种(不包括立体异构,下同),分子式为C5H12O并能与Na发生反应的有机物有y种,则x和y的关系为
| A.x=y | B.x>y | C.x<y | D.无法确定 |