某无色溶液中可能含有Na+、K+、Fe3+、NH4+、Cu2+、SO42-、SO32-、CO32-、Cl-、
Br-这几种离子中的若干种,依次进行下列实验,观察到的现象记录如下:
①pH试纸检验,溶液的pH>7。
②取少量原溶液,向溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成。
③另取少量原溶液,向溶液中滴加足量氯水,无气体产生,再加入CCl4振荡,静置后
CCl4层呈橙色,用分液漏斗分液。
④向分液后的水溶液中加入Ba(NO3)2溶液和HNO3溶液,有白色沉淀产生,过滤。
⑤在滤液中加入AgNO3和HNO3的混合溶液有白 色沉淀产生。
色沉淀产生。
则关于原溶液的判断中不正确的是
| A.肯定存在的离子是Na+、K+、SO32-、Br- |
| B.肯定不存在的离子是Fe3+、Cu2+、NH4+、SO42-、CO32- |
| C.无法确定原溶液中是否存在Cl- |
| D.若步骤④改用BaCl2溶液和盐酸的混合溶液,则对溶液中离子的判断无影响 |
NA为阿伏加德罗常数,下列说法正确的是()
| A.标准状况下,11.2L的戊烷所含的分子数为0.5NA |
| B.28g乙烯所含共用电子对数目为4NA |
| C.1 mol甲基的电子数目为7NA |
| D.现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3NA |
如图是某只含有C、H、O、N的有机物简易球棍模型。下列关于该有机物的说法错误的是()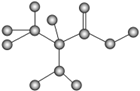
A.该有机物的分子式为C3H7O2N
B.该有机物的名称为α氨基丙酸
C.该有机物能发生加成反应
D.该有机物能发生酯化反应
可用来鉴别己烯、四氯化碳、苯的试剂是()
| A.硫酸 | B.溴水 | C.乙醇 | D.盐酸 |
下列各组中的反应属于同一反应类型的是( )
| A.苯的硝化反应;乙烯使溴水褪色 |
| B.葡萄糖与新制氢氧化铜共热;无水乙醇与浓硫酸共热制乙烯 |
| C.乙醇和乙酸制乙酸乙酯;乙烷和氯气得到氯乙烷 |
| D.乙醇和氧气制乙醛;苯和液溴制溴苯 |
下列实验能获得成功的是()
| A.用溴水可鉴别苯、CCl4、苯乙烯 |
| B.加浓溴水,然后过滤可除去苯中少量苯酚 |
| C.苯、溴水、铁粉混合制成溴苯 |
| D.可用分液漏斗分离乙醇和水 |