X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子 数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76 g/L-1;W的质子数是X、Y、Z、M四种元素质子数之和的1/2。下列说法正确的是( )
数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76 g/L-1;W的质子数是X、Y、Z、M四种元素质子数之和的1/2。下列说法正确的是( )
| A.元素原子第一电离能大小关系:Z>Y>W>X>M |
| B.XZ2、X2M2、W2Z2均为直线形的共价化合物 |
| C.Y与M形成化合物键长大于Z与M形成化合物的键长 |
| D.由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键 |
某烯烃与H2加成后的产物是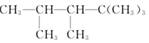 ,则该烯烃的结构式可能有
,则该烯烃的结构式可能有
| A.1种 | B.2种 | C.3种 | D.4种 |
有关烯烃的下列说法中正确的是
| A.烯烃分子中所有的原子一定在同一平面上 |
| B.烯烃在适宜的条件下只能发生加成反应不能发生取代反应 |
| C.分子式是C4H8的烃分子中一定含有碳碳双键 |
| D.烯烃既能使溴水褪色也能使酸性KMnO4溶液褪色 |
下列物质中,在一定条件下既能发生加成反应,也能发生取代反应,但不能使KMnO4酸性溶液褪色的是
| A.丙烯 | B.苯 | C.甲苯 | D.丙炔 |
由CH3CH3→CH3CH2Cl→CH2=CH2→CH3CH2OH的转化过程中的反应依次是
| A.取代消去加成 | B.裂解取代消去 |
| C.取代加成消去 | D.取代消去取代 |
已知某有机物A的红外光谱和核磁共振氢谱如图所示,下列说法中不正确的是
| A.由红外光谱可知,该有机物中至少有三种不同的化学键 |
| B.由核磁共振氢谱可知,该有机物分子中有三种不同的氢原子 |
| C.仅由其核磁共振氢谱无法得知其分子中的氢原子总数 |
| D.若A的化学式为C2H6O,则其结构简式为CH3—O—CH3 |