最早使用的化学电源(chemical power source))是锌锰电池,即大家所熟悉的干电池(dry cell),其结构如下图所示:尽管这种电池的历史悠久,但对它的电化学过程尚未完全了解。一般认为,放电时,电池中的反应如下:
E极:2MnO2+2H2O+2e- ="==" 2MnO(OH)+2OH-
F极:Zn+2NH4Cl === Zn(NH3)2Cl2+2H++2e-
总反应式: 2MnO2+Zn+2NH4Cl ="==" 2MnO(OH)+Zn(NH3)2Cl2
下列说法正确的是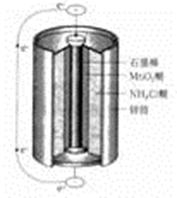
| A.E极是电池的正极,发生的是氧化反应 |
| B.F极是电池的负极,发生的是氧化反应 |
| C.从结构上分析,锌锰电池应属于可充电电池 |
| D.锌锰电池内部发生的氧化还原反应是可逆的 |
已知反应X+Y===M+N为吸热反应,对这个反应的下列说法中正确的是
| A.X的能量一定低于M的能量,Y的能量一定低于N的能量 |
| B.因为该反应为吸热反应,故一定要加热反应才能进行 |
| C.破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量 |
| D.X和Y的总能量一定低于M和N的总能量 |
对铜—锌—稀硫酸组成的原电池装置中,当导线中有1mol电子通过时,理论上的两极变化是:①锌片溶解了32.5克②锌片增重了32.5克③铜片上析出1克氢气④锌片上析出1mol氢气 ( )
| A.①③ | B.①④ | C.②③ | D.②④ |
如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向水槽中滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验中,不考虑两球的浮力变化)
| A.杠杆为导体或绝缘体时,均为A端高B端低 |
| B.杠杆为导体或绝缘体时,均为A端低B端高 |
| C.当杠杆为导体时,A端低B端高;杠杆为绝缘体时,A端高B端低 |
| D.当杠杆为导体时,A端高B端低;杠杆为绝缘体时,A端低B端高 |
下列说法中正确的是( )
①质子数相同的微粒一定属于同一种元素
②电子数相同的微粒不一定是同一种元素
③两个原子如果核外电子排布相同,一定是同一种元素
④质子数相同,电子数也相同的两种微粒,不可能是一种分子和一种离子
⑤所含质子数和电子数相等的微粒一定是原子
⑥同种元素的原子其质量数必相等
| A.①②④ | B.②③④ | C.③④⑥ | D.①⑤⑥ |
用铁片与稀硫酸反应制取氢气,下列的措施中,不能使氢气生成速率加快的是()
| A.加热 | B.不用稀硫酸,改用98﹪浓硫酸 |
| C.滴加少量硫酸铜溶液 | D.不用铁片,改用铁粉 |