如右图,a、b是石墨电极,Z是滴有酚酞的饱和氯化钠溶液,通电一段时间后,在a棒附近看到颜色变红明显,则电源y是 极,实验过程中还能观察到的现象是
,a棒发生的电极反应式为 ,b棒电极反应式为 。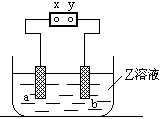
A、B、C、D、E、F六种短周期元素的原子序数依次增大,已知:①A原子核内只有1个质子;②B原子最外层电子数是次外层电子数的2倍;③C原子最外层电子数比次外层电子数多4个;④D原子的次外层电子数是最外层电子数的8倍;⑤E单质既能和盐酸反应,又能和烧碱反应;⑥F与C同主族。用化学符号回答下列问题:
(1)用电子式表示下列物质A2C2,DCA_________________;
(2)写出E与烧碱反应的离子方程式。
(3)写出DCA与B的最高价氧化物反应的化学方程式:
。
已知:甲、乙、丙为常见单质,甲常温下为固体,乙为一黄绿色气体,丙为无色气体。A、B、C、D均为化合物,D为一红褐色沉淀,它们之间有下图转化关系。请回答以下问题。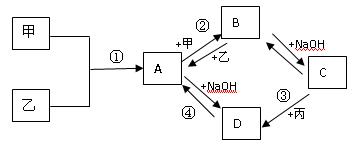
(1)写出下列物质的化学式;乙;B。
(2)写出③反应的化学方程式:。
(3)写出②反应的离子方程式:。
下列关于实验现象的描述,正确的是
①由铜锌组成的原电池,电子是从锌经过导线流向铜
②把铜片和锌片紧靠在一起浸入稀硫酸中,铜表面出现气泡
③把铜片插入三氯化铁溶液中,在铜片表面出现一层铁
④把锌片放入盛盐酸的试管中,加入几滴氯化铜溶液,产生气泡的速率加快
(1)给下列物质命名或写出结构简式:
(2)葡萄糖的结构简式
(3)乙酸与CH3CH218OH发生酯化反应的化学方程式,并注明反应条件
填写下列空白:
(1)写出表示含有8个质子、10个中子的原子的化学符号:;
(2)周期表中最活泼的非金属元素位于第族;
(3)所含元素种类是8种的周期是第、周期。
(4)氯元素在周期表中位于第周期第族。氯的最高价氧化物的化学式为,最高价氧化物的水化物的化学式为__________。
(5)物质在下列变化过程中克服的是:①共价键②离子键。(填序号)
HCl溶于水电解熔融NaCl制Na
电解水分解生成O2和H2
(6)在下述反应中,属于取代反应的是;属于氧化反应的是;属于加成反应的是。
①乙烯使溴水褪色②乙烯使酸性高锰酸钾溶液褪色③苯与浓硝酸制硝基