下列表示水解的离子方程式正确的是
A.CH3COO— + H2O CH3COOH + OH— CH3COOH + OH— |
B.NH4+ + H2O N N H4OH + H+ H4OH + H+ |
C.S2-+2H2O H2S+2 OH— H2S+2 OH— |
D.HCO3-+H2O  H3O++CO32- H3O++CO32- |
某同学仿照“喷泉”实验的原理,在实验室中做了一个“喷烟”实验,如图所示。他在甲、乙两个烧瓶中分别充入X、Y两种无色气体,在胶头滴管中盛有含酚酞的NaOH溶液,实验时将胶头滴管内的液体挤入甲烧瓶内,然后打开止水夹,便可以看到甲烧瓶中的导管口喷出白色的烟,同时甲烧瓶中的溶液颜色逐渐变浅。若已知X、Y是HCl、 、
、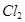 、
、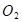 、
、 、
、 、NO其中气体中的两种,则下列判断中,正确的是()
、NO其中气体中的两种,则下列判断中,正确的是()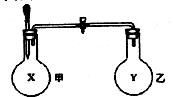
A.X是 ,Y是HCl ,Y是HCl |
B.X是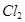 ,Y是 ,Y是 |
C.X是 ,Y是 ,Y是 |
D.X是NO,Y是 |
CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示。下列说法不正确的是()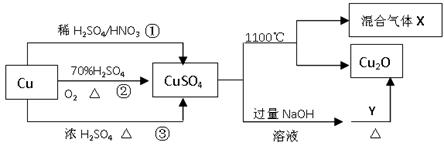
| A.途径①所用混酸中H2SO4与HNO3物质的量之比最好为3∶2 |
| B.相对于途径①、③,途径②更好地体现了绿色化学思想 |
| C.1molCuSO4在1100℃所得混合气体X中O2一定为0.75mol |
| D.Y可以是葡萄糖 |
下列表格中的各种情况,可以用右图的曲线表示的是 ()
| 反 应 |
纵坐标 |
甲 |
乙 |
|
| A |
相同质量的氨,在同一容器中 2NH3  N2 + 3H2 N2 + 3H2 |
氨气的转化率 |
500℃ |
400℃ |
| B |
等质量钾、钠分别与足量水反应 |
H2质量 |
钠 |
钾 |
| C |
在体积可变的恒压容器中,体积比 1︰3的N2、H2, N2 + 3H2  2NH3 2NH3 |
氨气的浓度 |
活性高的催化剂 |
活性一般的催化剂 |
| D |
2 molSO2和1 molO2,在相同温度下2SO2 + O2 2SO3 2SO3 |
SO3物质的量 |
2个大气压 |
10个大气压 |
将一定量铁粉和铜粉的混合物加入由稀硫酸和稀硝酸组成的混合溶液中,充分反应后金属粉末有剩余,下列有关推断正确的是()
| A.反应过程中不可能产生H2 |
| B.剩余的金属粉末中一定有铜 |
| C.往反应后的溶液中加入KSCN溶液会变血红色 |
| D.往反应后的溶液中加入足量的稀H2SO4,则金属粉末的质量一定会减少 |
室温下,将1.000mol·L-1盐酸滴入20.00mL 1.000mol·L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如下图所示。下列有关说法正确的是( )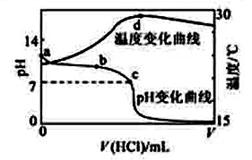
| A.a点由水电离出的c(H+)=1.0×10-14mol/L |
| B.b点:c(NH4+)+c(NH3·H2O) > c(Cl-) |
| C.c点:反应消耗的HCl 和NH3·H2O 的关系为:n(HCl)= n(NH3·H2O) |
| D.d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热 |