体积相同的甲和乙两个容器中,分别都充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2+O2 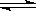 2SO3,并达到平衡,在该过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率为:( )
2SO3,并达到平衡,在该过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率为:( )
| A.等于p% | B.大于p% | C.小于p% | D.无法判断 |
对下列各种溶液中所含离子的判断合理的是
| A.向无色溶液中加氯水变橙色,溶液中可能含:Cl—、Br—、H+、Cu2+ |
| B.在常温下加入铝粉有氢气放出,则溶液中可能含:K+,Na+,H+,NO3- |
| C.常温,在c(H+)=10—14mol/L的溶液中可能含Na+,AlO2--,CO32-,SO32- |
| D.使紫色石蕊试液变蓝色的溶液中可能含:K+,Na+ ,Al3+,HCO3- |
下列离子方程式书写正确的是


| A.向碳酸氢钙溶液中加入足量氨水: Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O |
| B.向KI与稀硫酸的混合溶液中通入氧气:4H++O2+2I-=I2+2H2O |
| C.苯酚钠溶液中通入少量CO2: 2  -O- + CO2 + H2O → 2 -O- + CO2 + H2O → 2  -OH + CO32- -OH + CO32- |
| D.NH4HCO3溶液中滴入少量NaOH溶液:HCO3-+ OH- = CO32-+ H2O |
设阿伏加德罗常数为NA,下列说法正确的是
| A.1mol CnH2n+2烃分子中,含有碳碳键数目为nNA |
B.一定条件下,密闭容器中加入2mol SO2、1mol O2发生反应2SO2+O2 2SO3,转移的电子数目为4 NA 2SO3,转移的电子数目为4 NA |
| C.53g碳酸钠固体中,碳酸根离子的数目为0.5 NA |
| D.标准状况下,11.2L己烷所含分子数为0.5 NA |
两个极易导热的密闭容器a和b,容器a体积恒定,容器b体积可变,在温度、压强、体积相同条件下往a和b中分别通入等量NO 2,起始条件相同.发生反应:2NO 2(g)  N 2O 4(g),以下正确的是:
N 2O 4(g),以下正确的是:
| A. | 起始时,反应速度V a<V b | B. | 反应过程中,V a<V b |
| C. | 两容器达平衡所用时间一定相同 | D. | 达平衡时,两容器内强P a>P b |
下列事实一定能说明HF是弱酸的是


①常温下NaF溶液的pH大于7; ②用HF溶液做导电性实验,灯泡很暗;
③HF与NaCl不能发生反应; ④常温下0.1mol/L的HF溶液的pH为2.3
⑤HF能与Na2CO3溶液反应,产生CO2气体 ⑥HF与水能以任意比混溶
⑦1mol/L的HF水溶液能使紫色石蕊试液变红
| A.①②⑦ | B.②③⑤ | C.③④⑥ | D.①④ |