(4分)(1)写出电解饱和食盐水的 离子方程式____________________________________________
离子方程式____________________________________________
(2)写出工业上用氯气和石灰乳为原料制造漂白粉的化学方程式______________________
丙烷在燃烧时能放出大量的热,它也是液化石油气的主要成分,作为能源应用于人们的日常生产和生活。
已知:①2C3H8(g)+7O2(g)=6CO(g)+8H2O (l)△H1=﹣2741.8kJ/mol
②2CO (g)+O2(g)=2CO2(g)△H2=﹣566kJ/mol
(1)反应C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) 的△H= 。
(2)现有1mol C3H8在不足量的氧气里燃烧,生成1mol CO和2mol CO2以及气态水,将所有的产物通入一个固定体积为1L的密闭容器中,在一定条件下发生如下可逆反应:CO(g)+H2O(g) CO2(g)+H2(g)△H=+41.2kJ/mol
CO2(g)+H2(g)△H=+41.2kJ/mol
①下列事实能说明该反应达到平衡的是 。
a.体系中的压强不发生变化
b.V正(H2)="V" 逆(CO)
c.混合气体的平均相对分子质量不发生变化
d.CO2的浓度不再发生变化
②5min后体系达到平衡,经测定,H2为0.8mol,则v(H2O)= ;此时该反应的平衡常数K为 。
③向平衡体系中充入少量CO则平衡常数K (填“增大”、“减小”或“不变”)
依据(1)中的反应可以设计一种新型燃料电池,一极通入空气,另一极通入丙烷气体;燃料电池内部是熔融的掺杂着氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在其内部可以传导O2﹣,电池内部O2﹣由 极移向 极(填“正”或“负”);电池的负极电极反应式为 。
(3)用上述燃料电池和惰性电极电解足量Mg(NO3)2和NaCl的混合溶液.电解开始后阴极区的现象为 。
氧化还原反应在生产、生活中应用广泛,酸性KMnO4、H2O2、Fe(NO3)3是重要的氧化剂.用所学知识回答问题:
(1)3H2SO4+2 KMnO4+5H2O2=K2SO4+2MnSO4+5 O2↑+8 H2O,当有6 mol H2SO4参加反应的过程中,有 mol还原剂被氧化。
(2)在稀硫酸中,KMnO4能将H2C2O4氧化为CO2。该反应的化学方程式为 。
(3)取300mL 0.2mol/L的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则消耗KMnO4的物质的量的是 mol。
(4)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的离子方程式是 ,又变为棕黄色的原因是 。
卤代烃在工农业生产及人们的生活中具有广泛的用途。如四氯化碳可用作灭火剂、氟利昂曾用作冷冻剂、氯仿曾用作麻醉剂,卤代烃还是合成高分子化合物的原料。
已知下面三个反应(其中A为氯代烃,B为烯烃) :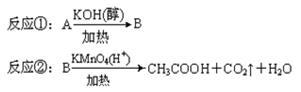
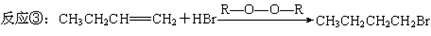
请回答下列问题:
(1)化合物B的分子式是 ,1 mol化合物B完全燃烧需要消耗标准状况下 L的氧气。
(2)由丙醇可以制备B,该反应的反应条件是 ,反应类型是 。
(3)写出B在有机过氧化物(R—O—O—R)中与HBr反应的化学方程式: 。
(4)假设A在核磁共振氢谱中有两组峰,且峰面积之比为6∶1,那么A在氢氧化钾水溶液中加热反应生成的有机化合物的结构简式是 。
(5)实验室检验A中是否含有氯元素,所加试剂的顺序是 。
A、B、C、D四种芳香族化合物都是某些植物挥发油中的主要成分,有的是药物,有的是香料。它们的结构简式如下: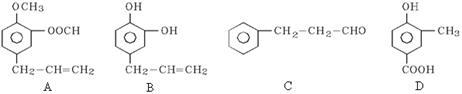
请回答下列问题:
(1) 写出B中官能团的名称: 。
(2)能发生银镜反应的有___________(填序号)。
(3)满足下列条件的D的同分异构体有 种。
①遇FeCl3溶液显紫色 ②能发生水解反应 ③苯环上的一氯代物有两种
(4)按下图,C经一步反应可生成E,E是B的同分异构体,则反应①的反应类型是 ,写出F的结构简式 。
写出下列反应的化学方程式:
(1)溴乙烷与氢氧化钠溶液反应 。
(2)氯乙烷与氢氧化钠的乙醇溶液共热 。
(3)丙醛与银氨溶液反应 。
(4)苯酚稀溶液与溴水反应 。
(5)己二酸与己二胺合成尼龙—66 。