(6分) 下图表示配制100 mL 0.100 mol·L-1 Na2CO3溶液的几个关键实验步骤和操作,据图回答下列问题: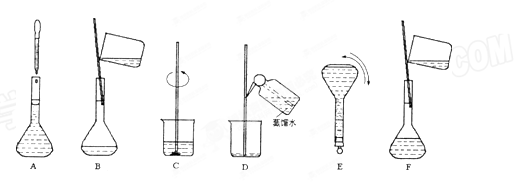
(1)步骤E中将一玻璃仪器上下颠倒数次,该仪器的名称是______。
(2)步骤B通常称为转移,步骤A通常称为____________。
(3)将上述实验步骤A—F按实验过程先后次序排列____________。
某同学设计实验证明铜与浓硫酸能发生反应,并检验生成气体的性质,如图所示,在试管里加入2mL浓硫酸,用带导管和一个小孔的胶管塞紧,从孔中插入一根铜丝,加热,把放出的气体依次通入品红溶液和石蕊溶液中。
请回答下列问题:
(1)写出铜与浓硫酸反应的化学方程式,标出电子转移的数目及方向:。
(2)试管a、b分别检验生成气体的性质,写出观察到的现象及其作用。
试管a中的现象是 ,
作用是 。
试管b中的现象是 ,
作用是 。
(3)装置中浸碱棉团的作用是 。
(4)如图将铜丝改为可抽动的铜丝符合化学实验绿色化的原因是。
要除去下表所列有机物中的杂质(括号内为杂质),从(Ⅰ)中选择适宜的试剂,从(Ⅱ)中选择分离提纯的方法,用序号填入表中。
(1)试剂:a.浓硫酸 b.氢氧化钠溶液 c.生石灰 d.碳酸钠溶液 e.水 f.浓溴水
(2)方法:A.过滤 B.分液 C.蒸馏
| 要提纯的物质 (杂质) |
溴乙烷(乙醇) |
乙醇(水) |
乙醇(乙酸) |
溴苯(溴) |
苯(苯酚) |
| (1)选用试剂 |
|||||
| (2)分离方法 |
(3)以上采用的操作中,B使用的主要玻璃仪器是____________________________。
某化学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了下图所示的实验装置和实验方案,请并回答相应问题。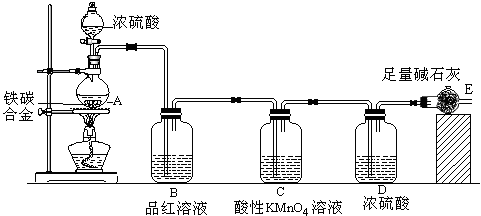
Ⅰ.探究浓硫酸的某些性质:
(1)按图示的连接装置,检查装置的气密性,称量E的质量。
(2)将ag铁碳合金样品放入A中,再加入适量的浓硫酸,未点燃酒精灯前,A、B基本上均无明显现象,其原因是_____________;加热A一段时间后,A、B中可观察到明显的现象,其中B中的现象__________,任写出一个A中发生反应的化学方程式________________________________________。
(3)反应相当一段时间后,从A中逸出气体的速率仍然较快,除因温度较高,其它可能的原因是。并且发现此时产生的气体具有可燃性,请用离子方程式表示产生此种气体的原因______________。
Ⅱ.测定铁的质量分数
(4)待A中不再逸出气体时,停止加热,拆下E并称重。E增重bg。则铁碳合金中铁的质量分数
为(写表达式)。
(5)最后对所得测量结果进行评价时,小组内有同学提出,本套装置在设计上存在多处缺陷而导致实验结果不准确,其中会导致铁质量分数测量值偏低是(任答一条即可)。
海波(Na2S2O3·5H2O)常用手纺织和造纸工业,海波是无色透明的晶体,易溶于水,遇酸立即分解:S2O32— + 2H+=S↓+ SO2↑+ H2O。硫化碱法是工业上制备海波的方法之一,反应原理为:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2
某研究小组在实验室用硫化碱法制备Na2S2O3·5H2O,实验装置如下图所示: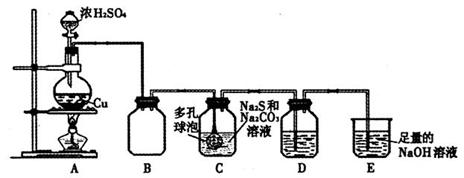
(1)装置A中滴加浓硫酸的仪器名称是,发生反应的化学方程式是,实验室还可以用A装置制取的气体单质有(填化学式)。
(2)装置C中连接多孔球泡可以提高SO2的吸收效率,其依据的原理是。
(3)装置D的作用是检验装置C中SO2的吸收效率,D中的试剂可以是。
a.品红溶液b.氢氧化钠溶液
c.酚酞溶液d.酸性高锰酸钾溶液
(4)装置E的作用是。
(5)实验制得的Na2S2O3·5H2O产品中可能含有Na2SO3、Na2SO4等杂质。请设计实验,检测Na2S2O3·5H2O产品中是否存在Na2SO4杂质,简要说明实验操作、现象和结论:。
(6)Na2S2O3溶液是定量实验中的常用试剂,为了测定某K2Cr2O7溶液的浓度,研究小组的同学准确量取10.00mL K2Cr2O7溶液于锥形瓶中,加入过量KI固体和适量的稀H2SO4,滴加指示剂,用0.1000 mol·L-1 Na2S2O3标准溶液滴定至终点,3次平行实验测得平均消耗Na2S2O3溶液的体积为30.00 mL,则c(K2Cr2O7) =mol·L-1。(已知:Cr2O72— +6I— +14H+=2Cr3+ +3I2 +7H2O,2S2O32—+ I2=S4O62—+2 I—)
研究性学习小组利用下列有关装置进行探究实验,回答相关问题。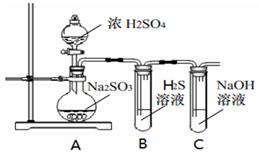
(1)写出A中的反应化学方程式
(2)实验时,旋开装置A中分液漏斗的旋塞,发现液体流出缓慢,最终停止,其可能的原因是。
(3)装置B中的溶液出现浑浊,该实验证明SO2具有性 。
(4)实验后,测定装置C中溶液呈碱性。溶液为什么呈碱性呢?大家有不同意见:①是生成的Na2SO3水解;②是氢氧化钠剩余。请设计实验方案证明哪种意见成立。选用下列试剂进行实验:Na2SO3溶液、酚酞溶液、氯水、BaCl2溶液、稀硫酸
| 实验步骤 |
实验操作 |
预期现象与结论 |
(5)另一小组利用装置D进行实验:用注射器向装置D共注入v mL实验室制备SO2的空气,当溶液刚好褪色,停止实验。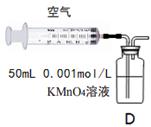
该小组的实验目的是。