下列有关热化学方程式的 叙述正确的是( )
叙述正确的是( )
| A.已知2H2(g)+O2(g) ="=" 2H2O(l);△H=-571.6kJ·mol-1,则氢气的燃烧热为285.8kJ·mol-1 |
| B.已知C(石墨,s)="=" C(金刚石,s);△H>0,则石墨比金刚石稳定 |
C.含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7k J的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq) ="=" CH3COONa(aq) + H2O(l) △H =-57.4kJ·mol-1 J的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq) ="=" CH3COONa(aq) + H2O(l) △H =-57.4kJ·mol-1 |
| D.已知2C(s)+2O2(g)=2CO2(g) △H1;2C(s)+O2(g)="2CO(g)" △H2,则△H1>△H2 |
用 0.1 mol·L NaOH溶液滴定0.1 mol·L
NaOH溶液滴定0.1 mol·L 盐酸,如果达到滴定终点时不慎堕加了1滴NaOH溶液(1滴溶液约为0.05 mL),继续加水至50 mL,所得溶液的PH是
盐酸,如果达到滴定终点时不慎堕加了1滴NaOH溶液(1滴溶液约为0.05 mL),继续加水至50 mL,所得溶液的PH是
| A.4 | B.7.2 | C.10 | D.11.3 |
某溶液中可能含有Na+、NH4+、Ba2+、SO42-、I-、S2-。分别取样:①用pH计测试,溶液显弱酸性;②加氯水和淀粉无明显现象。为确定该溶液的组成,还需检验的离子是
| A.Na+ | B.SO42- | C.Ba2+ | D.NH4+ |
下列溶液中微粒浓度关系一定正确的是
| A.氨水与氯化铵的pH=7的混合溶液中:C(Cl-)>C(NH4+) |
| B.pH=2的一元酸和pH=12的一元强碱等体积混合:C(OH-)= C(H+) |
| C.0.1 mol·L-1的硫酸铵溶液中:C(NH4+)>C(SO42-)>C(H+) |
| D.0.1 mol·L-1的硫化钠溶液中:C(OH-)=C(H+)+C(HS-)+C(H2S) |
常温下,用 0.1000 mol·L NaOH溶液滴定 20.00mL0.1000 mol·L
NaOH溶液滴定 20.00mL0.1000 mol·L
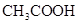 溶液所得滴定曲线如图。下列说法正确的是
溶液所得滴定曲线如图。下列说法正确的是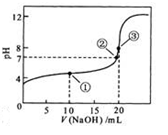
A.点①所示溶液中: |
B.点②所示溶液中: |
C.点③所示溶液中: |
D.滴定过程中可能出现: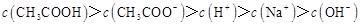 |
有关①100ml 0.1 mol/L 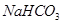 、②100ml 0.1 mol/L
、②100ml 0.1 mol/L 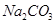 两溶液叙述不正确的是
两溶液叙述不正确的是
A.溶液中水电离出的 个数:②>① 个数:②>① |
B.溶液中阴离子的物质的量浓度之和:②>① |
C.①溶液中: |
D.②溶液中: |