20℃时,饱和KCl溶液的密度为1.174g·cm-3,物质的量浓度为4.0mol·L-1,则下列说法中正确的是( )
| A.将此溶液蒸发部分水,再恢复到20℃时,溶液密度一定大于1.174 g·cm-3 |
B.此溶液中KCl的质量分数为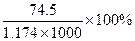 |
| C.密度大于1.174 g·cm-3的KCl溶液是过饱和溶液 |
| D.25℃时,饱和KCl溶液的浓度大于4.0 mol·L-1科网 |
下列有关溶度积常数Ksp的说法正确的是
| A.常温下,向BaCO3饱和溶液中加入Na2CO3固体,BaCO3的Ksp减小 |
| B.溶度积常数Ksp只受温度影响,温度升高Ksp减小 |
| C.溶度积常数Ksp只受温度影响,温度升高Ksp增大 |
| D.常温下,向Mg(OH)2饱和溶液中加入NaOH固体,Mg(OH)2的Ksp不变 |
在25 ℃时,FeS的Ksp=6.3×10-18,CuS的Ksp=1.3×10-36,ZnS的Ksp=1.3×10-24。下列有关说法中正确的是
| A.25 ℃时,CuS的溶解度大于ZnS的溶解度 |
| B.25 ℃时,饱和CuS溶液中Cu2+的浓度为1.3×10-36 mol·L-1 |
| C.向物质的量浓度相同的FeCl2、ZnCl2的混合液中加入少量Na2S,只有FeS沉淀生成 |
| D.除去某溶液中的Cu2+,可以选用FeS作沉淀剂 |
已知25℃,Fe(OH)3(s) Fe3+(aq)+3OH-(aq),Ksp;Fe3++3H2O
Fe3+(aq)+3OH-(aq),Ksp;Fe3++3H2O Fe(OH)3+3H+,Kh;水的离子积常数为Kw。下列Ksp、Kh、Kw的关系是
Fe(OH)3+3H+,Kh;水的离子积常数为Kw。下列Ksp、Kh、Kw的关系是
| A.Ksp·Kh=Kw3 | B.Ksp·Kw=Kh |
| C.Kh/Kw=Ksp | D.Kw/Kh=Ksp3 |
已知25 ℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,向100 mL该条件下的CaSO4饱和溶液中加入400 mL 0.01 mol·L-1 Na2SO4溶液,下列叙述正确的是
| A.溶液中析出CaSO4固体沉淀,最终溶液中c(SO42-)比原来的大 |
| B.溶液中无沉淀析出,溶液中c(Ca2+)、c(SO42-)都变小 |
| C.溶液中析出CaSO4固体沉淀,溶液中c(Ca2+)、c(SO42-)都变小 |
| D.溶液中无沉淀析出,但最终溶液中c(SO42-)比原来的大 |
用NA表示阿伏加德罗常数,下列结论能够成立的是
| A.0.1 mol·L-1的Na2CO3溶液中含有CO32-的个数是小于0.1NA |
| B.1 molFe与足量稀硝酸完全反应转移的电子数为2NA |
| C.0.2mol·L-1 CuSO4溶液加水稀释至体积增加1倍,其浓度变为0.1 mol·L-1 |
| D.4g NaOH固体溶解1L水中,所得溶液的物质的量浓度为0.1mol/L |