下列离子方程式中,正确的是( )
A.水玻璃中通入足量的CO2: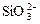 +2CO2+2H2O==H2SiO3 (胶体)+2CO +2CO2+2H2O==H2SiO3 (胶体)+2CO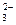 |
| B.氯化亚铁溶液中通入足量的Cl2:2Fe2++Cl2==2Fe3++2Cl- |
C.NaHCO3溶液中加入足量NaHSO4溶液: 2H++CO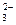 ==CO2↑+H2O ==CO2↑+H2O |
| D.碳酸氢钠溶液与少量石灰水反应:HCO3-+Ca2++OH-=CaCO3↓+H2O |
设反应① △H=akJ/mol.
△H=akJ/mol.
反应② △H=bkJ/mol,
△H=bkJ/mol,
以上两反应的平衡常数分别为K1和K2。在不同温度下,K1、K2的值如下:下列有关叙述正确的是
| T/K |
K1 |
K2 |
||||
| 973 |
1.47 |
2.38 |
||||
| 1173 |
2.15 |
1.67
|
已知C—C单键可以绕键轴旋转,其结构简式可表示为 的烃,下列说法中正确的是
的烃,下列说法中正确的是
| A.分子中至少有4 个碳原子处于同一直线上 |
| B.该烃的一氯代物最多有四种 |
| C.分子中至少有10个碳原子处于同一平面上 |
| D.该烃是苯的同系物 |
已知:
CH3CH2CH2CH3(g)+6.5O2(g) ==4CO2(g)+5H2O(l)ΔH=-2 878 kJ·mol-1
(CH3)2CHCH3(g)+6.5O2(g) ==4CO2(g)+5H2O(l)ΔH=-2 869kJ·mol-1
下列说法正确的是
| A.正丁烷分子储存的能量大于异丁烷分子 |
| B.正丁烷的稳定性大于异丁烷 |
| C.异丁烷转化为正丁烷的过程是一个放热过程 |
| D.异丁烷分子中的碳氢键比正丁烷的多 |
如图所示,将铁棒和石墨棒插入l L l mol·L-1食盐水中。下列说法正确的是
| A.若电键K与N连接,铁被保护不会腐蚀 |
| B.若电键K与N连接,正极反应式是4OH-—4e-=2H2O+O2↑ |
| C.若电键K与M连接,若在溶液中滴入酚酞试液,则在石墨棒附近先出现红色 |
| D.若电键K与M连接,当两极共产生28 L(标准状况)气体时,生成了1 mol NaOH |
相同温度下,体积均为0.5L的两个恒容密闭容器中发生可逆反应:X2(g)+3Y2(g)  2XY3(g)△H=-92.6kJ/mol;反应在起始及达到平衡时的有关数据如下表所示:下列叙述不正确的是
2XY3(g)△H=-92.6kJ/mol;反应在起始及达到平衡时的有关数据如下表所示:下列叙述不正确的是
| 容器 编号 |
起始时各物质的物质的量/mol |
达平衡时体系能量的变化 |
||||||
| X2 |
Y2 |
XY3 |
||||||
| ① |
1 |
3 |
0 |
放热46.3kJ |
||||
| ② |
0.4 |
1.2 |
1.2 |
Q
|