氢化钙固体登山运动员常用的能源提供剂。某兴趣小组拟选用如下装置制备氢化钙。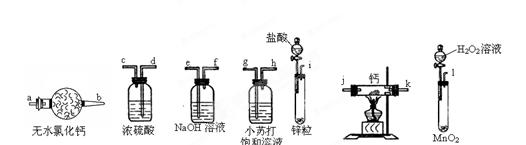
请回答下列问题:
(1)请选择必要的装置,按气流方向连接顺序为  (填仪器接口的字母编号);
(填仪器接口的字母编号);
(2)根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品;打开分液漏斗活塞_________(请按正确的顺序填入下列步骤的标号)。
| A.加热反应一段时间 | B.收集气体并检验其纯度 |
| C.关闭分液漏斗活塞 | D.停止加热,充分冷却 |
(3)实验结束后,某同学取少量产物,小心加入水中,观察到有气泡冒出,溶液中加入酚酞后显红色,该同学据此断,上述实验确有CaH2生成。
①写出CaH2与水反应的化学方程式 。
②该同学的判断不正确,原因是 。
(4)请你设计一个实验,用化学方法区分钙与氢化钙,写出实验简要步骤及观察到的现象 。
(5)登山运动员常用氢化钙作为能源提供剂,与氢气相比,其优点是 。
某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。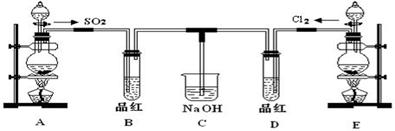
(1)实验室用装置A制备SO2。某同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未流下,你认为原因可能是。
(2)实验室用装置E制备Cl2,其反应的化学化学方程式为:
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O。若有6 mol的HCl参加反应,则转移的电子总数为。
MnCl2+Cl2↑+2H2O。若有6 mol的HCl参加反应,则转移的电子总数为。
(3)①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是:B:,D:。
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为B:,D:。
(4)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强。他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示)
。
某课外活动小组利用下图装置进行乙醇的催化氧化实验并制取乙醛,图中铁架台等装置己略去,粗黑线表示乳胶管。请填写下列空白: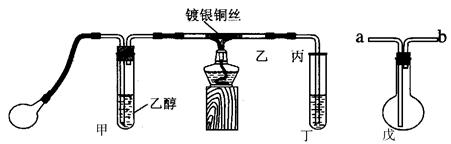
(1)甲装置常常浸在温度为70~80℃的水浴中,目的是。
(2)实验时,先加热玻璃管乙中的镀银钢丝,约1分钟后鼓入空气,此时铜可丝即呈红热状态。若把酒精灯撤走,控制一定的鼓气速度,铜丝能长时间保持红热直到实验结束。
(3)乙醇的催化氧化反应是反应(填“放热”或“吸热”),该反应的化学方程式为。
(4)在实验过程中控制鼓气的速度很重要:
①控制鼓气速度的方法是,
②若鼓气速度过快反应会停止,原因:,
③若鼓气速度过慢反应也会停止,原因:。
(5)若试管丁中用水吸收产物,则要在导管乙、丙之间接上戊装置,其连接方法是(填戊装置中导管代号):乙接、接丙。
如图实验装置用于验证某些物质的性质.在试管A中装入足量的固体NaHCO3.试回答下列问题: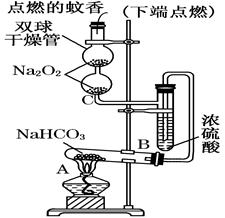
(1)在A试管内发生反应的化学方程式是_______________________________________________;
(2)B装置的作用是__________________________________________________;
(3)在双球干燥管内发生反应的化学方程式为___________________________________________;
(4)双球干燥管内观察到的实验现象是___ _____, 上述实验现象说明__________________;
(5)若将干燥管内的Na2O2换成Na2O,则双球干燥管内观察到的实验现象是______________________。
利用如图所示装置测定中和热的实验步骤如下:
步骤一:用量筒量取50ml 0.50 mol•L-1盐酸倒入小烧杯中,测出盐酸温度t1;
步骤二:用另一量筒量取50ml 0.55 mol•L-1 NaOH溶液,并用另一温度计测出其温度t2;
步骤三:将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度t3。
回答下列问题:
(1)步骤三中倒入NaOH溶液的正确操作是__________。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(2)使盐酸与NaOH溶液混合均匀的正确操作是________(填序号)。
A.轻轻地振荡烧杯 B.揭开硬纸片用玻璃棒搅拌
C.用温度计小心搅拌D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(3)___________(填“能”或“不能”)用Ba(OH)2溶液和硫酸代替NaOH溶液和盐酸测中和热,理由是________________________________________。
(4)在反应中若因为有放热现象,而造成少量HCl在反应中挥发,则测得的中和热_______(填“偏大”、“偏小”或“不变”)。
草酸亚铁(FeC2O4)常用作分析试剂、显影剂以及新型电池材料磷酸亚铁锂的生产。草酸亚铁在隔绝空气时加热能够分解,兴趣小组对草酸亚铁的分解产物进行了实验和探究。(已知:CO能与氯化钯[PdC12]溶液反应生成黑色的钯粉。)
(1)将草酸亚铁分解的气体产物依次通过澄清石灰水和氯化钯溶液,观察到澄清石灰水变浑浊,氯化钯溶液中有黑色物质生成。说明气体产物中有。(填化学式)
(2)探究草酸亚铁分解得到的黑色固体产物中铁元素的存在形式。
【发现问题】
草酸亚铁分解后得到的黑色物质是什么?
【提出假设】
猜想1:;猜想2:FeO;猜想3:FeO和Fe的混合物。
【实验方案】
限选试剂:盐酸、氯水、CuSO4溶液、KSCN溶液、蒸馏水。
| 实验步骤 |
实验现象 |
实验结论 |
| 步骤1:向试管中加入少量固体产物,再加入足量,充分振荡。 |
若溶液颜色明显改变, 且有红色固体生成。 |
有Fe存在。 |
| 步骤2:将步骤1中得到的浊液过滤,并用蒸馏水将固体洗涤至洗涤液呈无色。 |
||
| 步骤3:取步骤2得到的少量固体于试管中,滴加过量盐酸,静置后取上层清液, 。 |
。 |
有FeO存在。 |
【反思提升】
经兴趣小组讨论分析认为:草酸亚铁直接分解所得固体产物应该是FeO,而最终固体产物中还含有Fe是因为(写化学方程式)。
(3)根据实验探究和反思,写出草酸亚铁在隔绝空气时加热直接分解的化学方程式。