化学键使得一百多种元素构成了世界的万事万物.关于化学键的下列叙述中,正确的是:
| A.离子化合物一定含有共价键,共价化合物中不含离子键 |
| B.共价化合物可能含离子键,离子化合物中只含离子键 |
| C.构成单质分子的粒子一定含有共价键 |
| D.在氧化钠中,除氧离子和钠离子的静电吸引作用外,还存在电子与电子、原子核与原子核之间的排斥作用 |
元素在周期表中的位置,反映了元素的原子结构和元素的性质,下列说法正确的是
| A.只有非金属能形成含氧酸或含氧酸盐 |
| B.H3O+与OH-具有相同的质子数和电子数 |
| C.第三周期元素的最高正化合价等于它所处的主族序数 |
D.五种粒子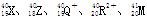 ,所属元素的种类是5种 ,所属元素的种类是5种 |
向某晶体的溶液中加入含Fe2+的溶液无明显变化,当滴加几滴溴水后,混合液出现红色,下列结论中错误的是
| A.Fe3+的氧化性比溴的氧化性强 |
| B.该晶体中一定含有SCN- |
| C.Fe2+与SCN-不能形成红色化合物 |
| D.Fe2+被溴氧化成Fe3+ |
医学界通过用14C标记的C60发现一种羧酸衍生物,在特定条件下,它可以通过断裂DNA抑制艾滋病病毒的繁殖。下列有关叙述中,正确的是
A.14C与12C的化学性质完全不同
B.14C与14N含有的中子数相同
C.14C60和12C60是碳元素的同素异形体
D.14C与12C、13C互为同位素
下列物质的电离方程式不正确的是
A.NaHCO3===Na++H++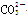 |
B. |
| C.AlCl3===Al3++3Cl- |
D.NaHSO4===Na++H++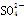 |
下列说法中正确的是
| A.胶体中分散质粒子直径小于1×10-9m |
| B.区别胶体与溶液的最简单的方法是丁达尔效应 |
| C.往NaOH溶液中滴入FeCl3溶液立即可制得胶体 |
| D.用半透膜分离胶体和悬浊液 |