在理论上不能用于设计原电池的化学反应是
A.H2SO4 (aq)+BaCl2(aq)=2HCl(aq)+BaSO4(s);△H<0 (aq)+BaCl2(aq)=2HCl(aq)+BaSO4(s);△H<0 |
B.CH3CH2OH(l)+3O2(g)  2CO2(g)+3H2 2CO2(g)+3H2 O(l) ;△H<0 O(l) ;△H<0 |
| C.4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s) ;△H<0 |
D.3Cu(s)+8HNO3(aq)=3Cu(NO3)2(aq)+2NO(g )+4H2O(l) ;△H<0 )+4H2O(l) ;△H<0 |
含有a mol FeBr2的溶液中,通入x mol Cl2。下列各项为通Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是
| A.x=0.4a,2Fe2++Cl2=2Fe3++2Cl- |
| B.x=0.6a,2Br-+ Cl2=Br2+2Cl- |
| C.x=a,2Fe2++2Br-+2Cl2=Br2+2Fe3++4Cl- |
| D.x=1.5a,2Fe2++4Br-+3Cl2=2Br2+2Fe3++6Cl- |
用含1 mol HCl的盐酸酸化含1 mol MgSO4的溶液,当向其中滴加1 mol/L 的Ba(OH)2溶液时,产生沉淀的物质的量(n)与加入 Ba(OH)2溶液体积(V)间的关系图正确的是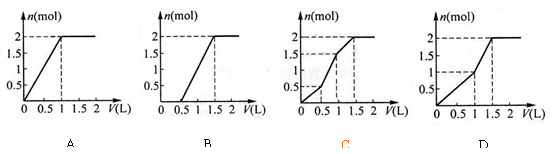
标准状况下VL氨气溶解在1L水中(水的密度近似为1g/ml),所得溶液的密度为ρ g/ml,质量分数为ω,物质浓度为c mol/L,则下列关系中不正确的是
| A.ρ=(17V+22400)/(22.4+22.4V) | B.ω="17c/(1000ρ)" |
| C.ω=17V/(17V+22400) | D.c=1000Vρ/(17V+22400) |
物质的量之比为2︰5的锌与稀硝酸反应,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比是
| A.1︰4 | B.1︰5 | C.2︰3 | D.2︰5 |
不能鉴别AgNO3、BaCl2、K2SO3和Mg(NO3)2四种溶液(不考虑他们间的相互反应)的试剂组是
| A.盐酸、硫酸 | B.盐酸、氢氧化钠溶液 |
| C.氨水、硫酸 | D.氨水、氢氧化钠溶液 |