下列反应中,属于氧化还原反应的是
| A.HCl十NaOH=NaCl+H2O | B.2Na+2H2O=2NaOH+H2↑ |
| C.CO2+2NaOH=Na2CO3+H2O | D.CaCO3 CaO+CO2↑ CaO+CO2↑ |
温度体积固定的容器中建立2NO2 N2O4平衡,平衡时NO2与N2O4物质的量浓度之比为Φ,条件不变的情
N2O4平衡,平衡时NO2与N2O4物质的量浓度之比为Φ,条件不变的情 况下,分别再充入NO2和再充入N2O4,平衡后会引起Φ的变化正确的是:
况下,分别再充入NO2和再充入N2O4,平衡后会引起Φ的变化正确的是:
| A.都引起Φ增大 | B.充入NO2引起Φ增大,充入N2O4引起Φ减小 |
| C.都引起Φ减小 | D.充入NO2引起Φ减小,充入N2O4引起Φ增大 |
有一瓶14%的KOH溶液,加热蒸发掉100g水后,变为28%的KOH溶液80mL,这80mL溶液的物质的量浓度为)
| A.5mol/L | B.6mol/L | C.6.25mol/L | D.6.75mol/L |
查处酒后驾驶采用的“便携式乙醇测量仪”以燃料电池为工作原理,在酸 性环境中,理论上乙醇可以被完全氧化为CO2,但实际乙醇被氧化为X,其中一个电极的反应式为:CH3CH2OH-2e-→X+2H+。下列说法中正确的是
性环境中,理论上乙醇可以被完全氧化为CO2,但实际乙醇被氧化为X,其中一个电极的反应式为:CH3CH2OH-2e-→X+2H+。下列说法中正确的是
| A.电池内部H+由正极向负极移动 |
| B.另一极的电极反应式为:O2 + 4e- + 2H2O = 4OH- |
| C.乙醇在正极发生反应,电子经过外电路流向负极 |
D.电池总反应为:2CH3CH2OH+O2→ 2CH3CHO+2H2O 2CH3CHO+2H2O |
在合成氨反应中,经过5秒钟,NH3的浓度增加了1.5mol·L-1,在这5秒钟内,下列平均 反应速率正确的是
反应速率正确的是
① v(NH3)=0.15 mol·L-1·s-1② v(H2)=0.45 mol·L-1·s-1
③ v(N2)=0.15 mol·L-1·s-1④ v(H2)=0.3mol·L-1·s-1
| A.①② | B.②③ | C.③④ | D.①④ |
将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是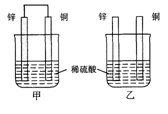
| A.两烧杯中铜片表面均无气泡产生 |
| B.甲中铜片是正极,乙中铜片是负极 |
| C.两烧杯中溶液的pH均增大 |
| D.产生气泡的速度甲比乙慢 |