(NH4)2Cr2O7是一种受热易分解的盐。下列各组对(NH4)2Cr2O7受热分解产物的判断,符合实际的是
| A.CrO3 + NH3 + H2O | B.Cr2O3 + NH3 + H2O |
C.CrO3 + N2 + H2O |
D.Cr2O3 + N2+ H2O |
完成下列实验所选择的装置或仪器(夹持装置已略去)正确的是
| A |
B |
C |
D |
|
| 实验 |
用CCl4提取碘水中的I2 |
分离乙醇中的I2 |
加热分解 MgCl2•6H2O得到 纯净的MgCl2 |
配制100mL 0.1000mol/L K2Cr2O7溶液 |
| 装置或仪器 |
 |
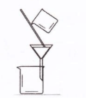 |
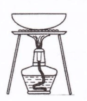 |
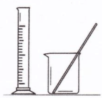 |
下列说法正确的是
| A.工业上冶炼铝常用焦炭还原氧化铝 |
| B.CO2、NO2或SO2都会导致酸雨的形成 |
| C.光导纤维、聚乙烯、油脂都是高分子化合物 |
| D.可通过加水吸收后再用半透膜渗析的方法分离PM2.5微粒与可溶性吸附物 |
反应A(g)+B(g) C(g) +D(g)过程中的能量变化如图所示,下列说法正确的是
C(g) +D(g)过程中的能量变化如图所示,下列说法正确的是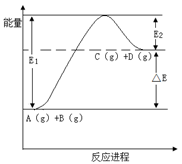
| A.该反应是放热反应 |
| B.加入催化剂后,反应加快,△E减小 |
| C.反应物的总键能大于生成物的总键能 |
| D.反应达到平衡时,升高温度,A的转化率增大 |
常温下有0.1mol·L-1的NaHA溶液,其pH=9,下列说法正确的是()
A.c(Na+)=c(HA-)+c(A2-)+c(H2A)
B.c(HA-)>c(Na+)>c(OH-)>c(H+)
C.c(Na+)>c(HA-)>c(OH-)>c(H2A)
D.c(H+)+2c(H2A)= c(OH-) +c(A2-)
下列说法正确的是
| A.原电池工作,阴离子移向正极 |
| B.铁片表面镀锌,铁片接电源负极 |
| C.用Cu作电极电解H2O,阳极反应为:4OH-- 4e-=2H2O+O2↑ |
| D.向AgCl饱和溶液中加入NaCl固体, c(Cl-)增大,Ksp增大 |