下列每组物质发生所述变化克服的作用属于同种类型的是( )
| A.氯化铝和干冰升华 | B.钠和硫熔化 |
| C.食盐和氯化氢溶解于水 | D.二氧化硅和二氧化硫熔化 |
下列各组中的两种物质相互反应时,无论哪种过量,都可用同一个离子方程式表示的是
①碳酸钠溶液与盐酸②硫化氢气体与氯化铁溶液③硫酸铝溶液与氨水
④硝酸银溶液与氨水⑤碘化亚铁溶液与氯水⑥碳酸氢钙溶液与澄清石灰水
| A.②③⑥ | B.①③⑥ | C.②④ | D.③⑤ |
下列离子方程式书写正确的是
A.碳酸氢镁溶液加入过量氢氧化钠: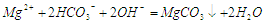 |
B.碳酸钡溶于醋酸溶液: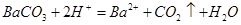 |
C.次氯酸钙溶液中通入少量二氧化碳: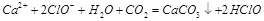 |
D.氧化铁加入氢碘酸中: |
科学家用一种称为“超酸”的化合物H(CB11H6Cl6)和C60反应,使C60获得一个质子,得到一种新型离子化合物[HC60]+[CB11H6Cl6]-。该反应看起来很陌生,其实在反应类型上可以跟中学化学里某个熟悉的化学反应相类似。该化学反应是
A.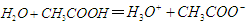 |
B.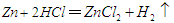 |
C.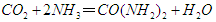 |
D.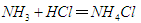 |
下列过程属于化学变化的是:①白色的硫酸铜粉末久置于空气中变成蓝色;②福尔马林用来浸制标本;③同素异形体之间的互变;④同分异构体之间的互变;⑤蜂蚁叮咬处涂稀氨水或小苏打溶液可减轻痛苦;⑥核裂变
| A.只有②③④⑤ | B.只有③④⑤ | C.只有①②③④⑤ | D.全部 |
分类法在化学学科发展中起到了非常重要的作用,下列分类依据合理的是
①根据氧化物的性质将氧化物分成酸性氧化物、碱性氧化物和两性氧化物等
②根据反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应
③根据分散系是否有丁达尔现象分为溶液、胶体和浊液
④根据组成元素的种类将纯净物分为单质和化合物
⑤根据电解质的水溶液导电能力的强弱将电解质分为强电解质和弱电解质
| A.②④ | B.②③④ | C.①③⑤ | D.①②④ |