 科技日报2007年1月30日讯:美、德两国科学家日前成功合成出具有独特化学特性的氢铝化合物(AlH3)n,其结构类似由硼和氢组成的硼烷,有关研究报告发表在最新出版的美国《科学》杂志上。最简单的氢铝化合物为Al2H6,它的熔点为150℃,燃烧热极高。Al2H6球棍模型如右图。下列有关推测肯定不正确的是( )
科技日报2007年1月30日讯:美、德两国科学家日前成功合成出具有独特化学特性的氢铝化合物(AlH3)n,其结构类似由硼和氢组成的硼烷,有关研究报告发表在最新出版的美国《科学》杂志上。最简单的氢铝化合物为Al2H6,它的熔点为150℃,燃烧热极高。Al2H6球棍模型如右图。下列有关推测肯定不正确的是( )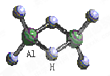

A.Al2H6跟水的反应可能是氧化还原反应,产物之一可能是氢氧化铝 |
B.Al2H6在空气中完全燃烧,产物为氧化铝和水 |
C.Al2H6分子是极性分子 |
|
| D.氢铝化合物可能成为未来的储氢材料和火箭燃料 |
下列实验装置设计与对应结论正确的是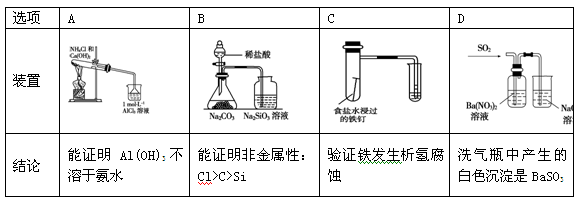
下列反应的离子方程式正确的是
A.AlCl3溶液中加入过量氨水:Al3++4NH3·H2O===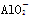 +2H2O+ +2H2O+ |
B.硫化钠的水解反应:S2-+2H2O H2S+2OH- H2S+2OH- |
C.将等体积等物质的量浓度的NaHCO3溶液与Ba(OH)2溶液混合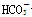 +Ba2++OH-===BaCO3↓+H2O +Ba2++OH-===BaCO3↓+H2O |
D.单质铜与稀硝酸反应:Cu+2H++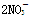 ===Cu2++2NO↑+H2O ===Cu2++2NO↑+H2O |
一种从植物中提取的天然化合物α-damascone可用于制作“香水”,
其结构为: ,有关该化合物的下列说法不正确的是
,有关该化合物的下列说法不正确的是
| A.分子式为C13H20O |
| B.该化合物可发生聚合反应 |
| C.与溴的CCl4溶液反应生成的产物经水解、稀硝酸酸化后可用AgNO3溶液检验 |
| D.1 mol该化合物完全燃烧消耗19 molO2 |
按以下实验方案可以从海洋动物柄海鞘中提取具有抗肿瘤活性的天然产物。
下列说法错误的是
| A.步骤(1)需要过滤装置 | B.步骤(2)需要用到分液漏斗 |
| C.步骤(3)需要用到坩埚 | D.步骤(4)需要蒸馏装置 |
下列有关说法中不正确的是
| A.将SO2通入BaCl2溶液中至饱和,无沉淀产生,再通入过量NH3,产生沉淀 |
| B.高纯硅常用作光导纤维的原料 |
| C.用AlCl3溶液制取Al(OH)3,沉淀剂选用氨水比选用NaOH溶液好 |
| D.纯锌与稀硫酸反应产生氢气的速率较慢,再加入少量CuSO4固体,反应速率加快 |