在两份体积相同的NaOH溶液中,分别通入CO2气体,充分反应后,在所得溶液A、B中分别加入1mol/L的盐酸,所加盐酸体积(mL)与产生CO2气体的体积(L)的关系如图所示,试填写下列空白:
⑴两份NaOH溶液A和B的物质的量浓度之比为 ,通入CO2气体的体积之比是(相同条件) 。
⑵与盐酸反应前,A溶液中的溶质是 ,其物质的量之比是 。
⑶与盐酸反应前,B溶液中的溶质是 ,其物质的量之比是 。
已知有五种元素的原子序数的大小顺序为C > A> B> D > E;A和C同周期,B和C同主族;A和B形成离子化合物A2B 中,所有离子的电子数相同,其电子总数为30;D和E可形成4核10电子的分子.试回答下列问题:
(1)写出以下元素的名称: ABE
(2)用电子式表示离子化合物A2B 的形成过程:
(3)写出D元素形成单质的结构式:
(4)写出下列物质的电子式:E与B形成的化合物:
A、B、E形成的化合物:
(5)A和B两元素形成的化合物A2B2中存在的化学键的类型是。
乙烯与乙烷的混合气体共a mol,与b mol氧气共存于一密闭容器中,点燃后充分反应,乙烯和乙烷全部消耗完,得到CO和CO2的混合气体和45 g水。试求:
(1)当a=1时,乙烯和乙烷的物质的量之比n(C2H4)∶n(C2H6)=________。
(2)当a=1,且反应后CO和CO2的混合气体的物质的量为反应前氧气的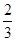 时,b=________,得到的CO和CO2的物质的量之比n(CO)∶n(CO2)=________。
时,b=________,得到的CO和CO2的物质的量之比n(CO)∶n(CO2)=________。
(3)a的取值范围为________。
根据下面的反应路线及所给信息填空。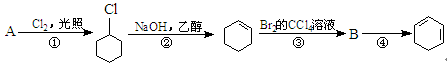
(1)A的结构简式是,名称是。
(2)①的反应类型是;②的反应类型是。
(3)反应④的化学方程式是 。
Ⅰ.麻黄素又称黄碱,是我国特定的中药材麻黄中含有的一种生成碱。经我国科学家研究发现其结构如下:
(1)麻黄素中含氧官能团的名称是________,属于________类(填“醇”或“酚”)。
(2)下列各物质:
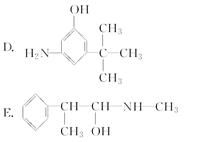
与麻黄素互为同分异构体的是________(填字母,下同),互为同系物的是________。
Ⅱ.某烃类化合物A的相对分子质量为84,分子中含有一个碳碳双键,其分子中只有一种类型的氢原子。
(1)A的结构简式为______________________;
(2)A中的碳原子是否都处于同一平面?________(填“是”或者“不是”)
(1) 的名称是__________________________________
的名称是__________________________________
(2)2,4,6三甲基5乙基辛烷的分子中共有________个甲基原子团。
(3)分子中有6个甲基而一溴代物只有1种的烷烃的分子式是_________,其结构简式是__________,名称是____________________。