某种氢氧燃料电池的电解液为KOH溶液。下列有关电池的叙述不正确的是
| A.负极反应式为:H2+2OH-—2e-===2H2O |
| B.工作一段时间后,电解液中的KOH的物质的量不变 |
| C.该燃料电池的总反应方程式为:2H2+O2===2H2O |
| D.用该电池电解CuCl2溶液,产生2.24LCl2(标准状况)时,有0.1mol电子转移 |
在元素周期表中前四周期的五种元素的位置关系如图所示。若B元素的核电荷数为Z,则五种元素的核电荷数之和为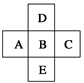
| A.5Z | B.5Z+18 |
| C.5Z+10 | D.5Z+8 |
下列关于1~18号元素的说法正确的是
| A.原子最外层电子数大于或等于3的元素一定是非金属元素 |
| B.原子最外层只有1个电子的元素一定是金属元素 |
| C.最外层电子数比次外层电子数多的元素一定位于第二周期 |
| D.H216O和D218O属于同位素 |
已知短周期元素的四种离子aW3+、bX+、cY2-、dZ-具有相同的电子层结构,下列关系正确的是
| A.离子的质子数:Y2->Z- | B.原子的最外层电子数:Z > W |
| C.元素的最高正价:X > W | D.原子半径:W > X |
已知R2+有b个中子,核外有a个电子,则R2+的质量数是
| A.a + b | B.a + b – 2 |
| C.a + b + 2 | D.b + 2 |
下列有关叙述中不正确的是
| A.在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素 |
| B.原子最外层电子数相同的元素不一定在同一族 |
| C.ⅧA族所含元素种类最多 |
| D.元素周期表是元素周期律的具体表现形式 |