下列反应的离子方程式中,书写正确的是
| A.钠跟水反应: Na + 2H2O = Na+ + 2OH-+ H2↑ |
| B.铁粉跟稀硫酸反应:2Fe + 6H+ = 2Fe3++ 3H2↑ |
| C.向A12(SO4)3溶液中加入过量的氨水:A13++3NH3·H2O=A1(OH)3↓+3NH4+ |
D.向硫酸溶液中加入Ba(OH)2溶液:H++SO +Ba2++OH-=H2O+BaSO4↓ +Ba2++OH-=H2O+BaSO4↓ |
室温下,下列各组离子在指定溶液中能大量共存的是()
| A.(NH4)2Fe(SO4)2溶液中:Ba2+、K+、OH-、Br- |
| B.通入过量SO2气体的溶液中:H+、Ba3+、NO3-、Fe3+ |
| C.c(OH-)/c(H+)=10-12的溶液中:NH4+、Cu2+、NO3-、Cl- |
| D.c(I-)=0.1mol/L的溶液中:Na+、Fe3+、ClO-、SO42- |
下列有关说法中正确的是( )
| A.有单质生成的反应,是氧化还原反应 |
| B.焰色反应是元素表现出来的化学性质 |
| C.由两种元素组成,原子个数比为1:1的物质一定是纯净物 |
| D.能与酸反应产物中有盐和水的氧化物不一定是碱性氧化物 |
下列离子组中所给的离子在水溶液中能大量共存,且当加入试剂后反应的离子方程式书写完全正确的是()
| 选项 |
离子组 |
加入试剂 |
发生反应的离子方程式 |
| A |
Fe3+、S2ˉ、Clˉ、Na+ |
NaOH溶液 |
Fe3++3OHˉ═Fe(OH)3↓ |
| B |
Na+、Al3+、Clˉ、SO42ˉ |
少量KOH溶液 |
Al3++3OHˉ═Al(OH)3↓ |
| C |
H+、Fe2+、SO42ˉ、NO3ˉ |
BaCl 2溶液 |
SO42ˉ+Ba2+═BaSO4↓ |
| D |
Na+、K+、ClOˉ、 SO42ˉ |
通入少量SO2 |
2ClOˉ+SO2+H2O═2HClO+SO32ˉ |
铅的冶炼大致过程如下:①富集:将方铅矿(PbS)进行浮选;
②焙烧:2PbS+3O2 2PbO+2SO2;
2PbO+2SO2;
③制粗铅:PbO+C Pb+CO;PbO+CO
Pb+CO;PbO+CO Pb+CO2。下列说法正确的是
Pb+CO2。下列说法正确的是
| A.浮选法富集方铅矿的过程属于化学变化 |
| B.方铅矿焙烧反应中,PbS是还原剂,还原产物只有PbO |
| C.整个冶炼过程中,制取1 molPb共转移2 mol电子 |
| D.将1mol PbS冶炼成Pb理论上至少需要6 g碳 |
用无机矿物资源生产部分材料,其产品流程示意图如下。下列有关说法不正确的是( )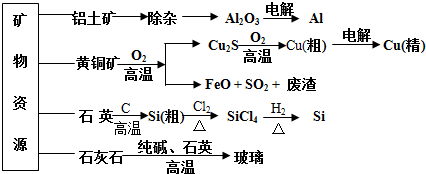
| A.制取玻璃的同时产生CO2气体,制取粗硅时生成的气体产物为CO |
| B.生产高纯硅、铝、铜及玻璃的过程中都涉及氧化还原反应 |
| C.粗硅制高纯硅时,提纯四氯化硅可用多次蒸馏的方法 |
| D.黄铜矿冶炼铜时产生的SO2可用于生产硫酸,FeO可用作冶炼铁的原料 |