高炉炼铁过程中发生的反应: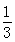 Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)
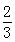 Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如下
Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如下
| 温度/℃ |
1000 |
1150 |
1300 |
| 平衡常数 |
4.0 |
3.7 |
3.5 |
下列说法正确的是
A.该反应的△H<0
B.该反应的平衡常数表达式是K=
C.降低温度将缩短反应达到平衡的时间
D.其他条件不变,升高温度,可以提高CO的平衡转化率
下列实验设计方案中,可行的是( )
| A.用加入适量NaCl溶液的方法除去Cu(NO3)2溶液中的AgNO3杂质 |
| B.用洗气瓶中的NaOH溶液除去CO2气体中混有的HCl气体 |
| C.向某无色溶液中仅加入BaCl2溶液,以检验未知溶液中的SO |
| D.先后添加石蕊试液、BaCl2溶液,可将盐酸、硫酸、硫酸钠、氢氧化钠和硝酸钾五种溶液鉴别开 |
下列实验装置图中没有涉及气体压强原理的是( )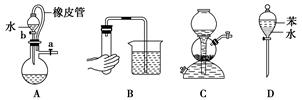
某实验室仅有如下仪器或用具:烧杯、铁架台、铁圈、三脚架、漏斗、分液漏斗、石棉网、酒精灯、玻璃棒、量筒、蒸发皿、圆底烧瓶、火柴。从缺乏仪器或用具的角度看,不能进行的实验操作项目是( )
| A.蒸发 | B.萃取 |
| C.过滤 | D.升华 |
下列仪器中常用于物质分离的是( )
| A.天平 | B.分液漏斗 |
| C.量筒 | D.集气瓶 |
已知乙酸乙酯(C4H8O2)是一种无色液体,不溶于水,密度小于1 g·mL-1,沸点约为55 ℃。要从水与乙酸乙酯的混合物中将乙酸乙酯分离出来,下列方法中最简便的是( )
| A.蒸馏 | B.分液 |
| C.过滤 | D.蒸发 |