粗镍经过下列过程可以转化为纯度99.9%的高纯镍,发生的反应是
下列说法正确的是
| A.50~80℃时,适当增大压强,有利于Ni(CO)4的生成 |
| B.180~200℃时,气态的Ni(CO)4 会分解出纯Ni |
| C.提纯过程中,CO(g)的量不断减少 |
| D.温度越高,Ni(CO)4 (g)的转化率越低 |
关于某有机物 的性质叙述正确的是
的性质叙述正确的是
| A.1 mol该有机物可以与3 mol Na发生反应 |
| B.1 mol该有机物可以与3 mol NaOH发生反应 |
| C.1 mol该有机物可以与6 mol H2发生加成反应 |
| D.1 mol该有机物分别与足量Na或NaHCO3反应,产生的气体在相同条件下体积相等 |
下列说法正确的是
| A.燃料电池由外设装备提供燃料和氧化剂 |
| B.Mg和Al通常用热还原的方法来冶炼 |
| C.绿色化学的核心是应用化学原理对环境污染进行治理 |
| D.蛋白质、棉花、淀粉、油脂都是由高分子组成的物质 |
仅用下表提供的仪器和药品,就能达到相应实验目的是
| 编号 |
仪器 |
药品 |
实验目的 |
| A |
托盘天平(带砝码)、胶头滴管、量筒、烧杯、药匙、玻璃棒 |
NaCl固体、蒸馏水 |
配制一定质量分 数的NaCl溶液 |
| B |
分液漏斗、烧瓶、锥形瓶、 导管及橡皮塞 |
盐酸、大理石、硅酸钠溶液 |
证明非金属性: Cl>C>Si |
| C |
酸式滴定管、胶头滴管、铁架台(带铁夹) |
已知浓度的盐酸、 待测NaOH溶液 |
测定NaOH溶液 的物质的量浓度 |
| D |
烧杯、分液漏斗、胶头滴管、铁架台 |
待提纯的A1C13溶液、NaOH溶液 |
提纯混有MgC12 杂质的AlCl3溶液 |
25°C时,c(CH3COOH)+c(CH3COO-)=0.1 mol/L的醋酸、醋酸钠混合溶液中,c(CH3COOH)、
c(CH3COO-)与pH的关系如图所示。下列有关该溶液的叙述不正确的是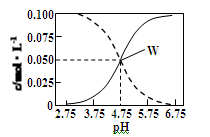
| A.pH=5的溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) |
| B.溶液中:c(H+)+c(Na+)=c(CH3COO-)+c(OH-) |
| C.由W点可以求出25°C时CH3COOH的电离常数 |
| D.pH =4的溶液中:c(H+)+c(Na+)+c(CH3COOH)-c(OH-)=0.1 mol/L |
根据原子结构及元素周期律的知识,下列叙述正确的是
| A.由于相对分子质量:HCl>HF,故沸点:HCl>HF |
| B.硅处于金属与非金属的过渡位置,硅可用作半导体材料 |
| C.由于氮元素的最低化合价只有-3价,故NH5这种物质不可能存在 |
| D.Cl-、S2-、Ca2+、K+半径逐渐减小 |