为使反应:Cu+2H 2O===Cu(OH)2+H2↑能够发生,下列设计方案正确的是( )
2O===Cu(OH)2+H2↑能够发生,下列设计方案正确的是( )
| A.用铜片作负极,石墨电极作正极,氯化钠溶液为电解质溶液构成原电池 |
| B.用铜片作电极,外接直流电源电解硫酸铜溶液 |
| C.用铜片作阳极,铁片作阴极,电解硫酸钠溶液 |
| D.用铜片作阴、阳电极,电解稀硫酸 |
下列实验、现象及有关结论不严密的是
| A |
B |
C |
D |
|
| 实验 |
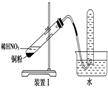 |
 |
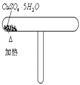 |
 |
| 现象 |
试管内水的液面下降且得到无色气体 |
加热时熔化的铝不滴落 |
加热蓝色变白色,冷却白色变蓝色 |
肥皂泡破裂,火柴点燃听见爆鸣声 |
| 结论 |
铜与稀硝酸反应生成的是NO气体 |
Al2O3的熔点比Al高 |
CuSO4和CuSO4·5H2O的互变实验 |
铁粉与水蒸气反应产生的氢气 |
已知A、B、C为中学化学中常见的单质。室温下,A为固体,B和C均为气体。在适宜的条件下,它们可以按如图进行反应。下列说法中正确的是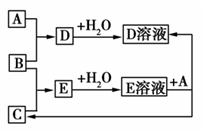
A.A、B、C中三种元素的任意两种元素形成的化合物所属物质类别可能是氧化物
B.A、B、C中有一种金属且为B
C.如果E溶液是一种强酸,则E溶液为硫酸
D.A、B、C中三种元素的任意两种元素形成的化合物所属物质类别一定不是碱
SO2与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,发生的两个化学反应如下(未配平):①SO2+Fe3++H2O→SO42-+Fe2++H+,②Cr2O72-+Fe2++H+→Cr3++Fe3++H2O。下列有关说法正确的是
| A.反应①配平后H2O的化学计量系数为3 |
| B.反应②中每生成14molH2O,电子转移6mol电子 |
| C.Cr2O72-能将Na2SO3氧化成 Na2SO4 |
| D.两个反应中Fe2(SO4)3均作还原剂 |
下列过程与离子反应方程式相匹配的是
| A.制备乙酸乙酯时将产生的蒸气导入饱和碳酸钠溶液中:CO32-+2H+===CO2↑+H2O |
| B.NH4HCO3溶于少量的Ba(OH)2溶液中:HCO3-+OH-+Ba2+===BaCO3↓+H2O |
| C.向亚硫酸钠溶液中滴加少量的新制氯水:2SO32-+Cl2+2H2O===2SO42-+2Cl-+4H+ |
| D.利用氯酸钾和浓盐酸制消毒剂ClO2:2ClO3-+4H++2Cl-===2ClO2↑+Cl2↑+2H2O |
下列有关物质性质的应用正确的是
| A.钠具有很强的还原性,可用钠与TiCl4溶液反应制取钛 |
| B.铝表面易形成致密的氧化膜,可用铝制贮罐盛装稀硝酸 |
| C.FeCl3具有很强的氧化性,可用于包括铜、不锈钢、铝等材料的蚀刻 |
| D.硫酸铜能与氯化钡反应,可用于给误食氯化钡的患者洗胃 |