Ⅰ.短周期元素X、Y、Z、W在元素周期表中的位置如图所示,其中X、Y、Z三种元素的质子数之和为21。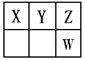
(1)写出W的简单离子的原子结构示意图 ;
氢元素与Z形成原子个数比为1∶1的化合物,其结构式为 。
(2)Y的最高价氧化物对应的水化物与Y的氢化物恰好完全反应,生成物的水溶液呈酸性,其原因是(用离子方程式表示) ;
(3)写出Y的最高价氧化物对应水化物的浓溶液与X在加热条件下反应的化学方程式
 ,
,
反应中每转移8mol 电子,消耗的还原剂质量为 g。
(4)写出能说明Y的非金属性比Z弱的一个实验事实:
Ⅱ.往1L体积不变的容器中加入0.200mol CO和1.00mol H2O(g),在t℃时反应:
CO+ H2O(g)  CO2+ H2达到平衡,若该反应的化学平衡常数K=1,则t℃时CO 的转化率为 。
CO2+ H2达到平衡,若该反应的化学平衡常数K=1,则t℃时CO 的转化率为 。
Ⅲ.甲醇燃料电池是一种相对理想的绿色能源,可用于电动汽车的电源;若该氢氧燃料电池以硫酸为电解质溶液,总反应为:2CH3OH + 3O2 = 2CO2+ 4H2O,则其正极的电极反应式
芳香醛与活性亚甲基化合物的缩合反应在有机合成中有重要应用,化合物III是医药中间体,其合成方法如下:
反应①: 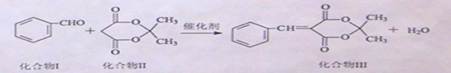
化合物Ⅱ也可以由化合物IV(C3H6Cl2)经以下途经合成:
(1)化合物II的分子式为,1mol化合物III最多与mol H2发生加成反应。
(2)化合物IV转化为化合物V的反应类型是,化合物V和化合物VII能形成一种高分子聚合物,写出该聚酯的结构简式。
(3)由化合物VI转变成化合物VII分两步进行,其中第一步是由化合物VI与足量的银氨溶液共热反应,写出其化学反应方程式。
(4)E是化合物II的同分异构体,且E是一种链状结构,在核磁共振氢谱中有3种氢, 1mol E能与2 molNaHCO3反应,写出化合物E的结构简式。(任写一种;不考虑顺反异构。)
(5)化合物I与化合物 (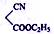 )在催化剂条件下也能发生类似反应①的反应得到另一医药中间体,写出该反应化学方程式。
)在催化剂条件下也能发生类似反应①的反应得到另一医药中间体,写出该反应化学方程式。
某探究小组将一批电子废弃物简单处理后,得到含Cu、Al、Fe及少量Au、Pt等金属的混合物,并设计如下制备硫酸铜晶体和无水氯化铁的方案:
已知:Cu2+ + 4NH3·H2O=[Cu(NH3)4]2+ + 4H2O
请回答下列问题:
(1)步骤①Cu与酸反应的离子方程式为。
(2)步骤②加H2O2的作用是,滤渣2为(填化学式)。
(3)步骤⑤不能直接加热脱水的理由是。
(4)若滤液1中Cu2+的浓度为0.02mol·L-1,则氢氧化铜开始沉淀时的pH =
(已知:Ksp[Cu(OH)2]=2.0×10-20)。
(5)已知:2Cu2++4I-= 2CuI↓+I2 I2+2S2O32-= 2I-+S4O62-
某同学为了测定CuSO4·5H2O产品的质量分数可按如下方法:取3.00g产品,用水溶解后,加入足量的KI溶液,充分反应后过滤、洗涤,将滤液稀释至250mL,取50mL加入淀粉溶液作指示剂,用0.080 mol·L-1 Na2S2O3标准溶液滴定,达到滴定终点的依据是。
四次平行实验耗去Na2S2O3标准溶液数据如下:
| 实验序号 |
1 |
2 |
3 |
4 |
| 消耗Na2S2O3标准溶液(mL) |
25.00 |
25.02 |
26.20 |
24.98 |
此产品中CuSO4·5H2O的质量分数为。
生产生活中广泛涉及氧化还原反应。
(1)工业上冶炼下列物质通常不采用电解法的是。
a.Nab.Mg c.Fe d.Ag
(2)下图为电解精炼铜的示意图,电极a为粗铜,则a连接电源的极,b极的电极反应式为。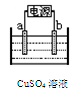
(3)汽车剧烈碰撞时,安全气囊中发生反应NaN3 + KNO3 → K2O + Na2O + X↑(未配平),已知X为单质,在反应中NaN3失去电子。则该反应的氧化剂为,X的化学式为,该反应的氧化剂和还原剂的物质的量之比为。
(4)工业上制取高纯度MnO2的某一步骤如图所示,请写出该反应的离子方程式。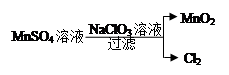
一定条件下,有如下反应:
2CO (g) + O2(g)=2CO2(g)ΔH1=" -" 566.0kJ·mol-1
3Fe(s) +2O2(g)=Fe3O4 (s)ΔH2=-1118.3kJ·mol-1
Fe3O4(s)+4CO(g) 3Fe(s) +4CO2 (g) ΔH3
3Fe(s) +4CO2 (g) ΔH3
(1)试计算,ΔH3 =
(2)已知1100℃时,反应Fe3O4(s)+4CO(g) 3Fe(s)+4CO2 (g) ΔH3的化学平衡常数为4.8×10-3。若在1100℃时,测得高炉中c(CO2)=0.020mol·L-1,c(CO)=0.10mol·L-1,此时该反应(填“是”或“否”)处于平衡状态,理由是,此时υ正υ逆(填“>”、“<”或“=”)。
3Fe(s)+4CO2 (g) ΔH3的化学平衡常数为4.8×10-3。若在1100℃时,测得高炉中c(CO2)=0.020mol·L-1,c(CO)=0.10mol·L-1,此时该反应(填“是”或“否”)处于平衡状态,理由是,此时υ正υ逆(填“>”、“<”或“=”)。
(3)下列试剂可以用于吸收工业尾气中的CO2的是。
a.(NH4)2CO3溶液 b.氨水 c.NaHSO3溶液 d.CaCl2溶液
A、B、C、X均为中学常见的物质,一定条件下它们的转化关系如下(副产物已略去)。
试回答:
(1)若X为O2,则A不可能是(填选项)。
a. Si b. NH3 c. Mg d. S
(2)若A、B、C的水溶液均显碱性,焰色反应均为黄色,X为CO2,用离子方程式解释B 溶液显碱性的原因,举出C的一种用途。
(3)若A是一种黄绿色气体单质,X是一种能使湿润的红色石蕊试纸变蓝的气体,反应①属于置换反应,写出反应①的化学方程式,C的水溶液中各离子浓度由大到小顺序为。