将洁净的金属片A、B 、C、D 分别放置在浸有盐溶液的滤纸上面并压紧(如图所示)。在每次实验时,记录电压指针的移动方向和电压表的读数如右表所示:
已知构成原电池两电极的金属活动性相差越大,电压表读数越大。请判断:
(1) A、B、C、D四种金属中活泼性最强的是_____________(用字母表示)
(2) 若滤纸改用NaOH溶液浸润一段时间后,则在滤纸上能看到有白色物质析出,后迅速变为灰绿色,最后变成褐色。则滤纸上方的金属片为___________(A、B、C、D中哪一种),此时对应的电极反应式为:正极___________________________________________
按要求完成下列问题:
(1)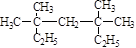 系统命名为 ;
系统命名为 ;
(2)4―甲基―1―戊烯的键线式为 。
(3)写出乙醛与新制氢氧化铜反应化学方程式;
(4)丙三醇与硝酸反应能生成三硝酸甘油酯,写出三硝酸甘油酯的结构简式
(5)下列有关实验的说法不正确的是_____________。
| A.制乙烯时,温度计应插入反应混合液中 |
| B.实验室用溴和苯在铁粉存在下反应,得到的溴苯显褐色,原因是溴苯在空气中被氧化 |
| C.检验C2H5Cl中氯元素时,将C2H5Cl和NaOH水溶液混合加热,然后用稀硫酸酸化,再加入AgNO3溶液 |
| D.做过银镜反应的试管用氨水洗涤,做过苯酚的试管用酒精洗涤 |
E.将一定量CuSO4和NaOH溶液混合后加入甲醛溶液,加热未产生砖红色沉淀,原因可能是NaOH量太少
下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白(填写序号不得分):
| 族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0族 |
| 2 |
① |
② |
③ |
|||||
| 3 |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
|||
| 4 |
⑨ |
⑩ |
(1)在这些元素中,化学性质最不活泼的是:。(填元素符号)
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是,碱性最强的化合物的化学式是:。
(3)比较①与⑤的最高价氧化物对应的水化物,的酸性强(填化学式);能通过说明(写反应的化学方程式)。
(4)实验室制取②的氢化物的化学方程式。
②的氢化物与②的最高价氧化物的水化物反应所得的产物化学式为。
(5)②可以形成多种氧化物,其中一种是红棕色气体,试用方程式说明该气体不宜采用排水法收集的原因(用化学方程式表示)。
(6)比较③与⑥的氢化物,更稳定(填化学式)。
(7)写出④的单质与水反应的离子方程式。
(8)写出⑦元素的离子结构示意图,该离子半径S2-(填“﹥”或“﹤”)写出⑩元素在周期表的位置。
有V、W、X、Y、Z五种元素,它们的核电荷数依次增大;且都小于20。其中只有X、Z是金属元素;V、Z元素原子最外层都只有一个电子;W、Y元素原子的最外层电子数相同,且W元素原子L层电子数是K层电子数的3倍;X元素原子的最外层电子数是Y元素原子最外层电子数的一半.由此推知:
V是、W是、X是、Y是、Z是(填元素符号)
请将5种物质:N2O、FeCl2、Fe(NO3)3、HNO3和FeCl3分别填入下面对应的横线上,组成一个未配平的化学方程式。
(1)+→+++H2O(不需配平)
(2)反应过程中,N2O与FeCl2的物质的量之比为。
不同金属离子在溶液中完全沉淀时,溶液的pH不同。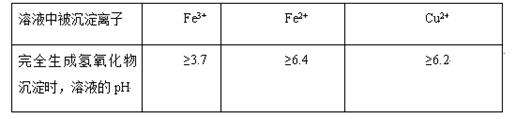
氯化铜晶体(CuCl2·2H2O)中含FeCl2杂质,为制得纯净氯化铜晶体,首先将其制成水溶液,然后按下面所示的操作步骤进行提纯。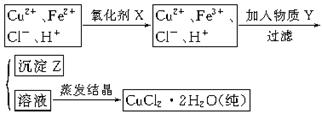
(1)下列氧化剂中适合作氧化剂X的是(填序号);
| A.NaClO | B.H2O2 | C.KMnO4 | D.Cl2 |
(2)物质Y的化学式是、;(任写两种)
(3)写出从(2)题任选一个物质Y参与反应生成沉淀Z离子方程式:。
(4)最后能不能直接蒸发结晶得到CuCl2·2H2O晶体?(填“能”或“不能”)。若能,不用回答;若不能,回答该如何操作?。
(5)氢氧化铜常温下其Ksp=c(Cu2+)· c2(OH-)=2×10-20mol2·L-2。某硫酸铜溶液里c(Cu2+)=0.02mol/L,如要生成Cu(OH)2沉淀,应调整溶液pH使之大于。